内蒙古包头市包钢四中2015-2016学年高一上学期化学期末考试试卷
试卷更新日期:2018-01-25 类型:期末考试
一、单选题
-
1. 化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )A、氧化镁用作耐火材料 B、Na2O常用于潜水艇或呼吸面具的供氧剂 C、明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 D、FeCl3溶液可用于刻制印刷铜电路板2. 关于Na2CO3和NaHCO3性质的说法不正确的是( )A、在水中的溶解性:NaHCO3<Na2CO3 B、相同条件下,与等浓度盐酸反应生成CO2的速率:NaHCO3<Na2CO3 C、等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出CO2更多 D、等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同3. 为了确定碳酸氢钠固体中是否含有碳酸钠.下列实验操作及判断中正确的是( )A、观察加热时能否放出气体 B、观察加盐酸时能否放出气体 C、溶于水中,加入澄清石灰水,观察是否有白色沉淀生成 D、溶于水中,滴加少量BaCl2溶液,观察是否有白色沉淀生成4. 用一种试剂就可以将NaOH、KSCN、AgNO3、Na2SO4四种无色溶液一一鉴别出来,这种试剂是( )A、稀盐酸 B、FeCl3 C、Fe(NO3)3 D、BaCl25. 下列推理正确的是( )A、铝粉在氧气中燃烧生成Al2O3 , 故钠在氧气中燃烧生成Na2O B、铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 C、活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 D、钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂6. 下列各组中的两种物质作用,反应条件(如温度等)或反应物用量改变,不会引起产物种类改变的是( )A、Na和O2 B、NaOH和CO2 C、AlCl3和NaOH D、Na2O2和CO27. 将一小块钠投入到CuCl2溶液中,观察到的现象是( )A、钠溶解,有铜析出并有气体产生 B、只有气体产生 C、只有沉淀产生 D、既有气体产生,又有蓝色沉淀产生8. 以Al2O3为原料制取氢氧化铝,最好的方法是( )A、将Al2O3溶于水 B、将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液 C、将Al2O3先溶于盐酸中,之后滴加氨水 D、将Al2O3先溶于NaOH溶液中,之后再滴加盐酸9. 下列各组溶液,只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的一组是( )A、KOH和Al2(SO4)3 B、稀H2SO4和NaHCO3 C、CaCl2和Na2CO3 D、Ba(OH)2和NaHSO410. 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为( )A、1:1 B、1:6 C、2:3 D、3:211. pH=1的无色透明溶液中,能大量共存的离子组是( )A、Al3+、Ag+、HCO3﹣、Cl﹣ B、Mg2+、NH4+、NO3﹣、Cl﹣ C、Ba2+、K+、Fe3+、Cl﹣ D、K+、Na+、OH﹣、CO32﹣12. 下列反应的离子方程式书写正确的是( )A、用小苏打治疗胃酸过多:CO3﹣+2H+═CO2↑+H2O B、钠与水反应:Na+2H2O═Na++2OH﹣+H2↑ C、硫酸铜溶液中加入过量铁粉:Cu2++2Fe═2Fe3++Cu D、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH﹣═2AlO2-+H2O13. 下列反应的离子方程式书写正确的是( )A、铁和盐酸反应 2Fe+6H+═2Fe3++3H2↑ B、小苏打溶液与少量澄清石灰水混合:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O C、AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓ D、Na2CO3溶液中通入少量CO2:CO32﹣+CO2+H2O═2HCO3﹣14. 在反应SO2+2H2S═3S+2H2O中,氧化产物与还原产物的物质的量之比为( )A、1:1 B、2:1 C、1:2 D、3:115. 将金属钠投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
①稀盐酸 ②K2SO4溶液 ③CuSO4溶液 ④饱和NaOH溶液.
A、④ B、③ C、①② D、③④16. 把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为( )A、1.0mol/L B、2.0mol/L C、3.0mol/L D、4.0mol/L17. 某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是( )
A、Fe3+ B、Mg2+ C、Fe2+ D、Al3+18. 向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )A、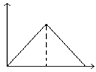 B、
B、 C、
C、 D、
D、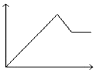 19. 根据反应式:(1)2Fe3++2I﹣=2Fe2++I2 , (2)Br2+2Fe2+=2Fe3++2Br﹣ , 判断下列离子的还原性由强到弱的顺序是( )A、Br﹣、Fe2+、I﹣ B、I﹣、Fe2+、Br﹣ C、Br﹣、I﹣、Fe2+ D、Fe2+、I﹣、Br﹣20. Na、Mg、Al三种金属各2mol分别跟1L 1mol∙L﹣1的盐酸反应时,相同条件下放出氢气体积最大的是( )A、Al B、Mg C、Na D、三者产生的氢气一样多21. 现有等体积,等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液,用物质的量浓度相同的AgNO3溶液分别完全沉淀三种溶液中的Cl﹣ . 所消耗AgNO3溶液的体积比为( )A、6:3:2 B、3:2:1 C、1:2:3 D、1:1:122. 某反应可用下式表示:xR2++yH++O2═mR3++nH2O. 则m的值为( )A、2x B、4 C、 D、723. 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )A、3:2 B、3:4 C、2:1 D、4:324. ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )A、CO2是氧化产物 B、H2C2O4在反应中被氧化 C、1mol KClO3参加反应,转移的电子为1mol D、H2C2O4的氧化性强于ClO2的氧化性25. 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+ . 下列说法不正确的是( )A、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 B、在H2O2分解过程中,溶液的酸碱性不变 C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 D、H2O2生产过程要严格避免混入Fe2+26. 在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是 , 氧化产物是 , 氧化产物与还原产物物质的量之比是 , 被氧化与未被氧化的HCl的质量之比为 , 若有7.3g HCl被氧化,则产生Cl2的质量为g,转移的电子数为mol.27. 物质有以下转化关系:
19. 根据反应式:(1)2Fe3++2I﹣=2Fe2++I2 , (2)Br2+2Fe2+=2Fe3++2Br﹣ , 判断下列离子的还原性由强到弱的顺序是( )A、Br﹣、Fe2+、I﹣ B、I﹣、Fe2+、Br﹣ C、Br﹣、I﹣、Fe2+ D、Fe2+、I﹣、Br﹣20. Na、Mg、Al三种金属各2mol分别跟1L 1mol∙L﹣1的盐酸反应时,相同条件下放出氢气体积最大的是( )A、Al B、Mg C、Na D、三者产生的氢气一样多21. 现有等体积,等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液,用物质的量浓度相同的AgNO3溶液分别完全沉淀三种溶液中的Cl﹣ . 所消耗AgNO3溶液的体积比为( )A、6:3:2 B、3:2:1 C、1:2:3 D、1:1:122. 某反应可用下式表示:xR2++yH++O2═mR3++nH2O. 则m的值为( )A、2x B、4 C、 D、723. 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )A、3:2 B、3:4 C、2:1 D、4:324. ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )A、CO2是氧化产物 B、H2C2O4在反应中被氧化 C、1mol KClO3参加反应,转移的电子为1mol D、H2C2O4的氧化性强于ClO2的氧化性25. 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+ . 下列说法不正确的是( )A、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 B、在H2O2分解过程中,溶液的酸碱性不变 C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 D、H2O2生产过程要严格避免混入Fe2+26. 在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是 , 氧化产物是 , 氧化产物与还原产物物质的量之比是 , 被氧化与未被氧化的HCl的质量之比为 , 若有7.3g HCl被氧化,则产生Cl2的质量为g,转移的电子数为mol.27. 物质有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)、A是 , B是 , C是 , X粉末是 .(2)、写出反应①的化学方程式 .(3)、写出反应②的离子方程式 .28. 把一定质量的镁、铝混合物投入到1mol•L﹣1的盐酸中,待金属完全溶解后,向溶液中加入1mol,•L﹣1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: (1)、写出下列各段反应的离子方程式
(1)、写出下列各段反应的离子方程式①0﹣30mL .
②30﹣80mL .
③80﹣90mL .
(2)、原溶液中盐酸的体积为mL(3)、原镁铝混合物中镁、铝的物质的量之比为 .二、推断题
-
29. 已知A为常见的金属单质,根据如图所示的关系:
 (1)、确定A、B、C、D、E、F的化学式,A为 , B为 , C为 , D为 , E为 , F为 .(2)、写出③、④、⑤的离子方程式.
(1)、确定A、B、C、D、E、F的化学式,A为 , B为 , C为 , D为 , E为 , F为 .(2)、写出③、④、⑤的离子方程式.③ .
④ .
⑤ .
三、实验题
-
30. 如图1所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
 (1)、B中盛有一定量的NaOH溶液,A中应预先加入试剂是 . A中反应的离子方程式是 .(2)、实验开始时应先将活塞a(填“打开”、“关闭”).(3)、简述生成Fe(OH)2的操作过程 .(4)、实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为 .(5)、下列图2各图示中能较长时间看到Fe(OH)2白色沉淀.
(1)、B中盛有一定量的NaOH溶液,A中应预先加入试剂是 . A中反应的离子方程式是 .(2)、实验开始时应先将活塞a(填“打开”、“关闭”).(3)、简述生成Fe(OH)2的操作过程 .(4)、实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为 .(5)、下列图2各图示中能较长时间看到Fe(OH)2白色沉淀.
-