2017-2018学年高二化学人教版选修4 第04章 电化学基础 单元测试卷
试卷更新日期:2018-01-23 类型:单元试卷
一、选择题
-
1. 下列产品的使用不会对环境造成污染的是( )A、含磷洗衣粉 B、氢气 C、一次电池 D、煤2. 在原电池和电解池的电极上所发生的反应,属于氧化反应的是( )A、原电池的正极和电解池的阳极所发生的反应 B、原电池的正极和电解池的阴极所发生的反应 C、原电池的负极和电解池的阳极所发生的反应 D、原电池的负极和电解池的阴极所发生的反应3. 下列叙述的方法不正确的是( )A、金属的电化学腐蚀比化学腐蚀更普遍 B、用铝质铆钉铆接铁板,铁板易被腐蚀 C、钢铁在干燥空气中不易被腐蚀 D、用牺牲锌块的方法来保护船身4. 下列关于实验现象的描述不正确的是( )A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 B、用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌 C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快5. 关于如图所示装置的叙述,正确的是( )

A、铜是阳极,铜片上有气泡产生 B、铜片质量逐渐减少 C、电流从锌片经导线流向铜片 D、铜离子在铜片表面被还原6. 关于电解NaCl水溶液,下列叙述正确的是( )A、电解时在阳极得到氯气,在阴极得到金属钠 B、若在阳极附近的溶液中滴入KI试液,溶液呈棕色 C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性7. 下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( ) A、a为负极、b为正极 B、a为阳极、b为阴极 C、电解过程中,氯离子浓度不变 D、电解过程中,d电极质量增加8. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) C、电池工作时,电子由正极通过外电路流向负极 D、外电路中每通过O.2mol电子,锌的质量理论上减小6.5g9. pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A、NaOH B、H2SO4 C、AgNO3 D、Na2SO410. 在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为( )A、1.62g B、6.48g C、3.24g D、12.96g11. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A、阳极发生还原反应,其电极反应式:Ni2+ + 2e-= Ni B、电解过程中,阳极质量的减少与阴极质量的增加相等 C、电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ D、电解后,电解槽底部的阳极泥中只有Cu和Pt12. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
A、a为负极、b为正极 B、a为阳极、b为阴极 C、电解过程中,氯离子浓度不变 D、电解过程中,d电极质量增加8. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) C、电池工作时,电子由正极通过外电路流向负极 D、外电路中每通过O.2mol电子,锌的质量理论上减小6.5g9. pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A、NaOH B、H2SO4 C、AgNO3 D、Na2SO410. 在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为( )A、1.62g B、6.48g C、3.24g D、12.96g11. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A、阳极发生还原反应,其电极反应式:Ni2+ + 2e-= Ni B、电解过程中,阳极质量的减少与阴极质量的增加相等 C、电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ D、电解后,电解槽底部的阳极泥中只有Cu和Pt12. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是( )
A、放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 B、充电时阳极反应为:Fe(OH)3 -3e- + 5 OH- = FeO + 4H2O C、放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2 D、放电时正极附近溶液的碱性增强13. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )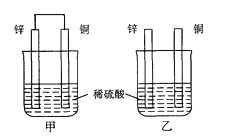 A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均增大 D、产生气泡的速度甲比乙慢14. 下列描述中,不符合生产实际的是( )A、电解熔融的氯化钠制取金属钠,用铁作阳极 B、电解法精炼粗铜,用纯铜作阴极 C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D、在镀件上电镀锌,用锌作阳极15. 下图
A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均增大 D、产生气泡的速度甲比乙慢14. 下列描述中,不符合生产实际的是( )A、电解熔融的氯化钠制取金属钠,用铁作阳极 B、电解法精炼粗铜,用纯铜作阴极 C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D、在镀件上电镀锌,用锌作阳极15. 下图 为直流电源,
为直流电源,  为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,  为电镀槽.接通电路后发现
为电镀槽.接通电路后发现  上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通  后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( ) A、a为直流电源的负极 B、c极发生的反应为2H++2e-=H2↑ C、f电极为锌板 D、e极发生还原反应
A、a为直流电源的负极 B、c极发生的反应为2H++2e-=H2↑ C、f电极为锌板 D、e极发生还原反应二、非选择题
-
16. 下图所示水槽中试管内有一枚铁钉,放置数天后观察:
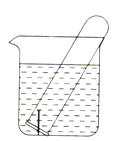 (1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。(3)、若试管内液面下降,则原溶液呈性,正极反应式为。17. 某课外活动小组研究电解饱和食盐水。甲、乙两位同学均采用了以下仪器和试剂:烧杯、直流电源、铁钉、碳棒、导线以及滴加了两滴酚酞试液的饱和NaCl溶液。(1)、甲同学设计的电解装置中,铁钉与直流电源的负极相连。通电后,很快可以观察到铁钉附近出现的现象为。但继续通电下,不久该现象就会消失,你认为其中的原因是。
(1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。(3)、若试管内液面下降,则原溶液呈性,正极反应式为。17. 某课外活动小组研究电解饱和食盐水。甲、乙两位同学均采用了以下仪器和试剂:烧杯、直流电源、铁钉、碳棒、导线以及滴加了两滴酚酞试液的饱和NaCl溶液。(1)、甲同学设计的电解装置中,铁钉与直流电源的负极相连。通电后,很快可以观察到铁钉附近出现的现象为。但继续通电下,不久该现象就会消失,你认为其中的原因是。甲同学的电解实验中,阳极反应式为 , 阴极反应式为。
(2)、乙同学设计的电解装置中,铁钉与直流电源的正极相连。若通电后,预期铁钉附近出现的现象为。18. 已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下:
回答下列问题:
(1)、加入CuO的作用是。(2)、步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的和极(填“正”或“负”)。 (3)、电解开始后,在U形管中可以观察到的现象有:。电解的离子方程式为。(4)、下列实验操作中必要的是(填写字母)。
(3)、电解开始后,在U形管中可以观察到的现象有:。电解的离子方程式为。(4)、下列实验操作中必要的是(填写字母)。(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)、铜的相对原子质量为(用带有m、V的计算式表示)。