备考2018年高考化学一轮基础复习:专题26 难溶电解质的沉淀溶解平衡
试卷更新日期:2018-01-19 类型:一轮复习
一、单选题
-
1. 把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)
 Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( ) A、溶液中Ca2+数目增多 B、溶液中c(Ca2+)增大 C、溶液pH值不变 D、溶液pH值增大2. 已知:Ksp(AgCl)=1.8×10-10 , Ksp(AgI)=1.5×10-16 , Ksp(Ag2CrO4)=2.0×10-12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )A、AgCl >AgI> Ag2CrO4 B、AgCl> Ag2CrO4 >AgI C、Ag2CrO4>AgCl >AgI D、Ag2CrO4>AgI >AgCl3. 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( ) A、溶液中Ca2+数目增多 B、溶液中c(Ca2+)增大 C、溶液pH值不变 D、溶液pH值增大2. 已知:Ksp(AgCl)=1.8×10-10 , Ksp(AgI)=1.5×10-16 , Ksp(Ag2CrO4)=2.0×10-12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )A、AgCl >AgI> Ag2CrO4 B、AgCl> Ag2CrO4 >AgI C、Ag2CrO4>AgCl >AgI D、Ag2CrO4>AgI >AgCl3. 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;Ka•Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
A、①④ B、①②④ C、①②④⑤ D、①②③④4. 下列有关说法正确的是( )A、若2,2,3,3﹣四甲基戊烷由烯烃加成而来,则该烯烃的名称是2,2,3,3﹣四甲基﹣1﹣﹣戊烯 B、在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 C、在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 D、在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动5. 对Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=1.2×10﹣11)、AgCl(Ksp=1.56×10﹣10)三种物质,下列说法正确的是( )A、Mg(OH)2的溶解度最小 B、Ca(OH)2的溶解度最小 C、AgCl的溶解度最小 D、同一温度下Ksp越大的溶解度也越大6. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )提示BaSO4(s)⇌Ba2+(aq)+SO42﹣(aq)的平衡常数Ksp=[Ba2+]•[SO42﹣],称为溶度积常数.
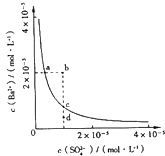 A、加入Na2SO4可以使溶液由a点变到b点 B、通过蒸发可以使溶液由d点变到c点 C、d点无BaSO4沉淀生成 D、a点对应的Ksp大于c点对应的Ksp7.
A、加入Na2SO4可以使溶液由a点变到b点 B、通过蒸发可以使溶液由d点变到c点 C、d点无BaSO4沉淀生成 D、a点对应的Ksp大于c点对应的Ksp7.在湿法炼锌的电解循环溶液中,较高浓度的Cl﹣会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4 , 生成CuCl沉淀从而除去Cl﹣ . 根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
 A、Ksp(CuCl)的数量级为10﹣7 B、除Cl﹣反应为Cu+Cu2++2Cl﹣=2CuCl C、加入Cu越多,Cu+浓度越高,除Cl﹣ . 效果越好 D、2Cu+=Cu2++Cu平衡常数很大,反应趋于完全8. 由下列实验及现象不能推出相应结论的是( )
A、Ksp(CuCl)的数量级为10﹣7 B、除Cl﹣反应为Cu+Cu2++2Cl﹣=2CuCl C、加入Cu越多,Cu+浓度越高,除Cl﹣ . 效果越好 D、2Cu+=Cu2++Cu平衡常数很大,反应趋于完全8. 由下列实验及现象不能推出相应结论的是( )实验
现象
结论
A.
向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D.
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
A、A B、B C、C D、D9. 25℃CaCO3固体溶于水达饱和时物质的量浓度是9.327×10﹣5 mol/L,则CaCO3在该温度下的Ksp为( )A、9.3×10﹣5 mol/L B、9.7×10﹣9 mol2/L2 C、7.6×10﹣17 mol4/L4 D、8.7×10﹣9 mol2/L2二、填空题
-
10. 含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10﹣3 mol•L﹣1的Cr2O72﹣ . 为了使废水的排放达标,进行如下处理:
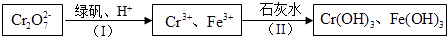
①绿矾化学式为FeSO4•7H2O.反应(I)的离子方程式为 .
②若处理后的废水中c(Cr3+)=3.0×10﹣6 mol•L﹣1 , 则废水中c(Fe3+)=mol•L﹣1 . (Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31)
三、实验探究题
-
11. 根据问题填空:(1)、室温下: pH=13的CH3COONa溶液加水稀释100倍后,pH11(填“>”“=”或“<”);(2)、pH相等时,①NH4Cl②(NH4)2SO4③NH4HSO4三种溶液中c(NH4+)由大到小的顺;(3)、等体积、等浓度的氢氧化钠与醋酸混合后,溶液中c(Na+)c(CH3COO﹣)(填“>”“=”或“<”); pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈性;(4)、用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图.
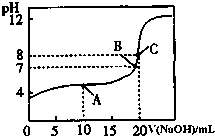
①为减小实验误差,由图可知滴定时指示剂应选用;(填“石蕊”、“酚酞”、“甲基橙”);
②A点的离子浓度大小关系是
③A,B,C三点所示溶液导电能力最强的是 点对应的溶液;
④A,B,C三点水的电离程度大小关系是;
(5)、相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol•L﹣1盐酸③0.1mol•L﹣1氯化镁溶液④0.1mol•L﹣1硝酸银溶液中,C(Ag+)大小顺序: . (用序号表示)四、综合题
-
12. 利用化学原理可以对工厂排放的废水、废渣等进行有效检测.某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+ , 其次是Fe3+ , Fe2+ , Al3+ , Ca2+ , Mg2+)

常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子
Fe3+
Fe2+
Mg2+
Al3+
Ca2+
Cr3+
开始沉淀时的pH
1.9
7.0
9.6
4.2
9.7
﹣
沉淀完全时的pH
3.2
9.0
11.1
8.0
11.7
9.0(>9.0溶解)
(1)、酸浸时,为了提高浸取率可采取的措施是(至少一条)(2)、调pH=4.0是为了除去(填Fe3+ , Al3+ , Ca2+ , Mg2+)(3)、钠离子交换树脂的原理为Mn++n NaR→MRn+nNa+ , 被交换的杂质离子是(填Fe3+ , Al3+ , Ca2+ , Mg2+)(4)、试配平下列氧化还原反应方程式: Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4 .13. 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)、常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈性,原因是;(用离子方程式表示)(2)、在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于;(3)、已知在H2S溶液中存在下列平衡:H2S═HS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向移动,(填“左”或“右”)c(H+) . (填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向移动,(填“左”或“右”)c(S2﹣) . (填“增大”、“减小”或“不变”)
(4)、常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 . 则m1 m2 . (选填“<”、“=”、“>”)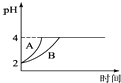 (5)、难溶电解质在水溶液中存在溶解平衡.某MgSO4溶液里c(Mg2+)=0.002mol•L﹣1 , 如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于;(该温度下Mg(OH)2的Ksp=2×10﹣11)
(5)、难溶电解质在水溶液中存在溶解平衡.某MgSO4溶液里c(Mg2+)=0.002mol•L﹣1 , 如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于;(该温度下Mg(OH)2的Ksp=2×10﹣11)
-
-