高中化学人教版 选修四 第一章 化学反应与能量 第一节 化学反应与能量的变化 化学反应与能量第一课时(焓变 反应热)
试卷更新日期:2018-01-16 类型:同步测试
一、选择题
-
1. 下列说法正确的是( )A、焓变的单位kJ·mol-1 , 是指1 mol物质参加反应时的能量变化 B、当反应放热时ΔH>0,反应吸热时ΔH<0 C、一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-” D、一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”2. 由图分析,下列说法正确的是( )
 A、A→B+C和B+C→A两个反应吸收或放出的能量不等 B、A→B+C ΔH<0 C、A具有的焓高于B和C具有的焓的总和 D、A→B+C ΔH>0,则B+C→A ΔH<03. 已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是( )A、在相同的条件下,红磷比白磷能量高 B、在相同的条件下,白磷比红磷稳定 C、红磷和白磷的结构不同 D、红磷容易发生自燃而白磷则不会自燃4. 下列说法中不正确的是( )A、分解反应大多数是吸热反应 B、氢氧化钾与硝酸的反应是放热反应 C、燃料有足够的空气就能充分燃烧 D、放热反应的过程,都可以看成是“储存”在物质内部的能量转化为热能、光能、电能等被释放出来的过程5. 固体酒精是目前饭桌上常用的火锅燃料,关于固体酒精燃烧过程的叙述正确的是( )A、不发生状态变化 B、反应中化学能转化为热能 C、没有化学键断裂 D、不存在氧化还原反应6. 下列说法正确的是( )A、反应热是1 mol物质参加反应时的能量变化 B、当反应放热时ΔH>0,反应吸热时ΔH<0 C、任何条件下,化学反应的焓变都等于化学反应的反应热 D、在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓的差值来决定7. 下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )A、
A、A→B+C和B+C→A两个反应吸收或放出的能量不等 B、A→B+C ΔH<0 C、A具有的焓高于B和C具有的焓的总和 D、A→B+C ΔH>0,则B+C→A ΔH<03. 已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是( )A、在相同的条件下,红磷比白磷能量高 B、在相同的条件下,白磷比红磷稳定 C、红磷和白磷的结构不同 D、红磷容易发生自燃而白磷则不会自燃4. 下列说法中不正确的是( )A、分解反应大多数是吸热反应 B、氢氧化钾与硝酸的反应是放热反应 C、燃料有足够的空气就能充分燃烧 D、放热反应的过程,都可以看成是“储存”在物质内部的能量转化为热能、光能、电能等被释放出来的过程5. 固体酒精是目前饭桌上常用的火锅燃料,关于固体酒精燃烧过程的叙述正确的是( )A、不发生状态变化 B、反应中化学能转化为热能 C、没有化学键断裂 D、不存在氧化还原反应6. 下列说法正确的是( )A、反应热是1 mol物质参加反应时的能量变化 B、当反应放热时ΔH>0,反应吸热时ΔH<0 C、任何条件下,化学反应的焓变都等于化学反应的反应热 D、在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓的差值来决定7. 下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )A、 石墨转变为金刚石是吸热反应
B、
石墨转变为金刚石是吸热反应
B、 白磷比红磷稳定
C、
白磷比红磷稳定
C、 S(g)+O2(g) =SO2(g) ΔH1 , S(s)+O2(g) =SO2(g) ΔH2 则ΔH1>ΔH2
D、
S(g)+O2(g) =SO2(g) ΔH1 , S(s)+O2(g) =SO2(g) ΔH2 则ΔH1>ΔH2
D、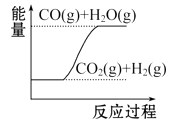 CO(g)+H2O(g) =CO2(g)+H2(g) ΔH1>0
8. 已知:H2(g)+F2(g) =2HF(g) ΔH=-546.6 kJ·mol-1 , 下列说法中不正确的是( )A、44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 B、1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ C、相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 D、2 mol H—F键的键能比1 mol H—H键和1 mol F—F 键的键能之和大546.6 kJ9. 下列反应属于氧化还原反应,且生成物的总能量高于反应物的总能量的是( )A、铝热反应 B、铝与盐酸反应 C、Ba(OH)2·8H2O晶体和NH4Cl晶体反应 D、灼热的炭与CO2反应10. 下列说法正确的是( )A、需要加热才能发生的反应一定是吸热反应 B、放热反应在常温下一定很容易发生 C、物质发生化学反应一定伴随着能量变化 D、凡是吸热或放热过程中热量的变化均称为反应热11. 已知反应X + Y =M + N,该反应为吸热反应,下列说法不正确的是( )A、无法比较X的能量与M的能量的大小 B、Y的能量可能小于N的能量 C、X和Y的总能量一定小于M和N的总能量 D、因该反应为吸热反应,所以一定要在加热条件下才能反应12. 已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O=O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为( )A、920 kJ B、557 kJ C、436 kJ D、188 kJ13. 对于化学反应:2Na+2H2O=2NaOH+H2↑的有关叙述错误的是( )A、该反应中既有旧化学键的断裂,也有新化学键的形成 B、该反应中每消耗1 mol Na,则同时消耗18 g H2O,产生1 mol NaOH和11.2 L H2(标准状况下) C、由于该反应常温下能自动进行,故该反应一定是放热反应 D、由于该反应是放热反应,所以断裂旧化学键所吸收的能量一定比形成新化学键所放出的能量少14. 关于吸热反应的说法,正确的是( )A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应 C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应15. 下列各图中表示正反应是吸热反应的图是( )A、
CO(g)+H2O(g) =CO2(g)+H2(g) ΔH1>0
8. 已知:H2(g)+F2(g) =2HF(g) ΔH=-546.6 kJ·mol-1 , 下列说法中不正确的是( )A、44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 B、1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ C、相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 D、2 mol H—F键的键能比1 mol H—H键和1 mol F—F 键的键能之和大546.6 kJ9. 下列反应属于氧化还原反应,且生成物的总能量高于反应物的总能量的是( )A、铝热反应 B、铝与盐酸反应 C、Ba(OH)2·8H2O晶体和NH4Cl晶体反应 D、灼热的炭与CO2反应10. 下列说法正确的是( )A、需要加热才能发生的反应一定是吸热反应 B、放热反应在常温下一定很容易发生 C、物质发生化学反应一定伴随着能量变化 D、凡是吸热或放热过程中热量的变化均称为反应热11. 已知反应X + Y =M + N,该反应为吸热反应,下列说法不正确的是( )A、无法比较X的能量与M的能量的大小 B、Y的能量可能小于N的能量 C、X和Y的总能量一定小于M和N的总能量 D、因该反应为吸热反应,所以一定要在加热条件下才能反应12. 已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O=O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为( )A、920 kJ B、557 kJ C、436 kJ D、188 kJ13. 对于化学反应:2Na+2H2O=2NaOH+H2↑的有关叙述错误的是( )A、该反应中既有旧化学键的断裂,也有新化学键的形成 B、该反应中每消耗1 mol Na,则同时消耗18 g H2O,产生1 mol NaOH和11.2 L H2(标准状况下) C、由于该反应常温下能自动进行,故该反应一定是放热反应 D、由于该反应是放热反应,所以断裂旧化学键所吸收的能量一定比形成新化学键所放出的能量少14. 关于吸热反应的说法,正确的是( )A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应 C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应15. 下列各图中表示正反应是吸热反应的图是( )A、 B、
B、 C、
C、 D、
D、 16. 下列关于能量的变化及反应热的说法中正确的是( )A、任何化学反应都有反应热 B、某些化学键断裂时吸收能量,某些化学键断裂时则放出能量 C、形成新化学键不一定放出能量 D、有热量变化的过程一定有化学键的断裂与形成17. 下列各项与反应热的大小无关的是( )A、反应物和生成物的状态 B、反应物量的多少 C、反应物的性质 D、反应的快慢18. 下列叙述正确的是( )A、化学反应一定只伴随热量的变化 B、凡是吸热或放热过程中热量的变化均称为反应热 C、若△H<0,则反应物的能量高于生成物的能量 D、若△H>0,则反应物的能量高于生成物的能量19. 已知反应C(金刚石,s)= C(石墨,s)的焓变ΔH=-Q(Q> 0),由此得出的正确结论是( )A、金刚石转化为石墨的反应是吸热反应 B、金刚石坚硬而石墨质软 C、金刚石比石墨稳定 D、石墨比金刚石稳定20. 下列反应中,生成物的总能量大于反应物的总能量的是( )A、氢气在氧气中燃烧 B、铁丝在氧气中燃烧 C、硫在氧气中燃烧 D、焦炭在高温下与水蒸气反应21. 将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。该现象说明了( )A、该反应是吸热反应 B、该反应是放热反应 C、铁粉和硫粉在常温下难以发生反应 D、生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量22. 生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
16. 下列关于能量的变化及反应热的说法中正确的是( )A、任何化学反应都有反应热 B、某些化学键断裂时吸收能量,某些化学键断裂时则放出能量 C、形成新化学键不一定放出能量 D、有热量变化的过程一定有化学键的断裂与形成17. 下列各项与反应热的大小无关的是( )A、反应物和生成物的状态 B、反应物量的多少 C、反应物的性质 D、反应的快慢18. 下列叙述正确的是( )A、化学反应一定只伴随热量的变化 B、凡是吸热或放热过程中热量的变化均称为反应热 C、若△H<0,则反应物的能量高于生成物的能量 D、若△H>0,则反应物的能量高于生成物的能量19. 已知反应C(金刚石,s)= C(石墨,s)的焓变ΔH=-Q(Q> 0),由此得出的正确结论是( )A、金刚石转化为石墨的反应是吸热反应 B、金刚石坚硬而石墨质软 C、金刚石比石墨稳定 D、石墨比金刚石稳定20. 下列反应中,生成物的总能量大于反应物的总能量的是( )A、氢气在氧气中燃烧 B、铁丝在氧气中燃烧 C、硫在氧气中燃烧 D、焦炭在高温下与水蒸气反应21. 将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。该现象说明了( )A、该反应是吸热反应 B、该反应是放热反应 C、铁粉和硫粉在常温下难以发生反应 D、生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量22. 生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:化学键
N≡N
F-F
N-F
键能/kJ·mol-1
941.7
154.8
283.0
下列说法中正确的是( )
A、过程N2(g)= 2N(g)放出能量 B、过程N(g)+3F(g)= NF3(g)放出能量 C、反应N2(g)+3F2(g)= 2NF3(g)吸收热量 D、NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应23. 已知某化学反应2B2A(g)= A2(g)+2B2(g)(B2A、A2、B2的分子结构分别为B─A─B、A=A、B—B)的能量变化如图所示,下列有关叙述不正确的是( )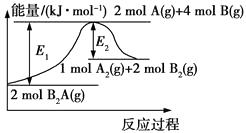 A、该反应的进行一定需要加热 B、该反应的ΔH=(E1-E2) kJ·mol-1 C、由2 mol A(g)和4 mol B(g)形成1 mol A=A键和2 mol B—B键,放出E2 kJ能量 D、该反应中,反应物的键能总和大于生成物的键能总和24. 已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH=−1269kJ/mol
A、该反应的进行一定需要加热 B、该反应的ΔH=(E1-E2) kJ·mol-1 C、由2 mol A(g)和4 mol B(g)形成1 mol A=A键和2 mol B—B键,放出E2 kJ能量 D、该反应中,反应物的键能总和大于生成物的键能总和24. 已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH=−1269kJ/mol②
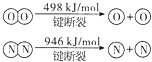
下列说正确的是( )
A、断开1 mol O=O键比断开1 mol N≡N键所需能量多448 kJ B、断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6 kJ C、由以上键能的信息可知H2O的沸点比NH3高 D、由元素非金属性的强弱可知 H-O键比H-N键弱25. 下列反应中生成物总能量高于反应物总能量的是( )A、碳酸钙受热分解 B、乙醇燃烧 C、铝粉与氧化铁粉末反应 D、氧化钙溶于水26. 已知Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0;则下列关于该反应的叙述不正确的是( )A、该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 B、上述热化学方程式中的ΔH的值与反应物的用量无关 C、该反应的化学能可以转化为电能 D、反应物的总能量高于生成物的总能量27. 27.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:( ) A、194 B、391 C、516 D、658
A、194 B、391 C、516 D、658二、填空题
-
28. 反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。  (1)、该反应是反应(填“吸热”、“放热”)。(2)、反应体系中加入催化剂对反应热是否有影响?(填“有”、“无”),原因是。(3)、在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2(填“增大”、“减小”、“不变”)。29. 下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
(1)、该反应是反应(填“吸热”、“放热”)。(2)、反应体系中加入催化剂对反应热是否有影响?(填“有”、“无”),原因是。(3)、在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2(填“增大”、“减小”、“不变”)。29. 下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题: (1)、有关反应的离子方程式是 ,
(1)、有关反应的离子方程式是 ,试管中看到的现象。
(2)、S形导管中液面A(填“上升”或“下降”),原因;说明此反应是(填“放热”或“吸热”)反应。30. 一定条件下,A与B反应可生成C和D,其能量变化如图: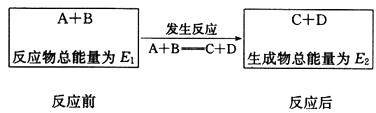 (1)、下列有关反应A+B=C+D的说法正确的是_______(填字母)。A、反应前后原子的种类和数目一定不变 B、该反应若有热量变化,则一定是氧化还原反应 C、若该反应为放热反应,则不需要加热反应就一定能自发进行 D、反应物的总质量及总能量与生成物的总质量、总能量均相等(2)、若E1<E2 , 则反应热ΔH0(填“>”“<”或“=”)。31. 下图是某同学设计的探究反应热效应的观察装置。其操作顺序是:①按图所示将实验装置连接好。②在U形管内加入少量红墨水溶液(或品红)。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。③在中间的试管里盛有1 g 氧化钙,当滴入2 mL左右的蒸馏水后,即可观察。
(1)、下列有关反应A+B=C+D的说法正确的是_______(填字母)。A、反应前后原子的种类和数目一定不变 B、该反应若有热量变化,则一定是氧化还原反应 C、若该反应为放热反应,则不需要加热反应就一定能自发进行 D、反应物的总质量及总能量与生成物的总质量、总能量均相等(2)、若E1<E2 , 则反应热ΔH0(填“>”“<”或“=”)。31. 下图是某同学设计的探究反应热效应的观察装置。其操作顺序是:①按图所示将实验装置连接好。②在U形管内加入少量红墨水溶液(或品红)。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。③在中间的试管里盛有1 g 氧化钙,当滴入2 mL左右的蒸馏水后,即可观察。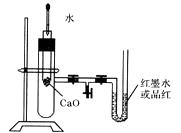
试回答:
(1)、实验中观察到的现象是。(2)、该实验中必须进行的一步实验操作是。(3)、该实验的原理是。(4)、实验中进行的化学方程式是。(5)、该实验表明CaO和H2O的能量与Ca(OH)2的能量之间的关系为。32. 下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量(kJ)
243
193
151
432
366
298
436
根据上述数据回答(1)~(5)题。
(1)、下列物质本身具有的能量最低的是______________。A、H2 B、Cl2 C、Br2 D、I2(2)、下列氢化物中,最稳定的是______________。A、HCl B、HBr C、HI(3)、X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?答:。(4)、相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是。三、简答题
-
33. 已知拆开1 mol H2、1 mol O2中的化学键需要消耗的能量分别为436 kJ、496 kJ,形成1 mol H—O键释放的能量为463 kJ。试说明2 mol H2(g)在适量O2中燃烧生成水蒸气的能量变化。