高中化学人教版 选修四 第一章 化学反应与能量 第二节 燃烧热 能源
试卷更新日期:2018-01-16 类型:同步测试
一、选择题
-
1. “优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列行为不符合这个要求的是( )A、将煤转化成气体燃料可以有效地减少“温室效应”的气体产生 B、加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用 C、研制开发以水代替有机溶剂的化工涂料 D、大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源2. 下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是( )
物质
CH4
C2H2
H2
燃烧热/kJ/mol
890.3
1299.6
285.8
A、C≡C键能为796.0 kJ/mol B、C—H键键长小于H—H键 C、2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol D、2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol3. 在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放出72.58kJ,下列热化学方程式正确的是( )A、CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=+725.8kJ/mol B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1451.6kJ/mol C、CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ/mol D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=+1451.6kJ/mol4. 新能源的开发利用是人类社会可持续发展重要课题。下列物质属于新能源的是A、氢气 B、煤炭 C、天然气 D、石油5. 下列有关描述中正确的是( )A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol B、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 C、需要加热才能发生的反应一定是吸热反应 D、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol6. 下列依据热化学方程式得出的结论正确的是( )A、若2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 , 则H2的燃烧热为241.8kJ·mol-1 B、若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定 C、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1 , 则20.0gNaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 D、已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2 , 则ΔH1>ΔH27. 下列叙述正确的是( )A、电能是二次能源 B、水力是二次能源 C、天然气是二次能源 D、水煤气是一次能源8.已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/
mol,金刚石的燃烧热为395.0kJ/mol.下列说法或表达正确的是
( )
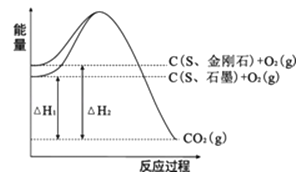 A、金刚石比石墨稳定 B、C(s、石墨)=C(s、金刚石)△H=+1.5kJ/mol C、△H1<△H2 D、如果使用催化剂,△H1和△H2都变小9. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol B、CO的标准燃烧热是△H=-283.0KJ/mol,则反应CO(g)+ O2(g)═CO2(g)的△H=﹣283.0KJ/mol C、需要加热才能发生的反应一定是吸热反应 D、1 mol硫燃烧生成气态三氧化硫所放出的热量是硫黄的燃烧热10. 白磷会对人体造成严重的烧伤,白磷(P4)分子结构为
A、金刚石比石墨稳定 B、C(s、石墨)=C(s、金刚石)△H=+1.5kJ/mol C、△H1<△H2 D、如果使用催化剂,△H1和△H2都变小9. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol B、CO的标准燃烧热是△H=-283.0KJ/mol,则反应CO(g)+ O2(g)═CO2(g)的△H=﹣283.0KJ/mol C、需要加热才能发生的反应一定是吸热反应 D、1 mol硫燃烧生成气态三氧化硫所放出的热量是硫黄的燃烧热10. 白磷会对人体造成严重的烧伤,白磷(P4)分子结构为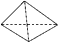 。下列说法不正确的是( ) A、白磷着火点低,在空气中可自燃 B、白磷、红磷互为同素异形体 C、31 g白磷中,含P—P键1.5 mol D、已知P4(白磷,s)+3O2(g)=2P2O3(s) ΔH=-Q kJ·mol-1 , 则白磷的燃烧热为Q kJ·mol-111. 下列做法不利于环境保护的是( )A、开发太阳能、水能、风能、地热能等新能源 B、大力开采煤、石油和天然气,以满足人们日益增长的能源需求 C、大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 D、减少资源消耗,注重资源的重复使用、资源的循环再生12. 下列热化学方程式,正确的是( )A、4g固体硫完全燃烧生成SO2 , 放出37 kJ热量:S(s)+O2(g)=SO2(g)ΔH= -296kJ/mol B、1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)
。下列说法不正确的是( ) A、白磷着火点低,在空气中可自燃 B、白磷、红磷互为同素异形体 C、31 g白磷中,含P—P键1.5 mol D、已知P4(白磷,s)+3O2(g)=2P2O3(s) ΔH=-Q kJ·mol-1 , 则白磷的燃烧热为Q kJ·mol-111. 下列做法不利于环境保护的是( )A、开发太阳能、水能、风能、地热能等新能源 B、大力开采煤、石油和天然气,以满足人们日益增长的能源需求 C、大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 D、减少资源消耗,注重资源的重复使用、资源的循环再生12. 下列热化学方程式,正确的是( )A、4g固体硫完全燃烧生成SO2 , 放出37 kJ热量:S(s)+O2(g)=SO2(g)ΔH= -296kJ/mol B、1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H= -73kJ/mol
C、甲烷的标准燃烧热为-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g) ΔH=-890.3kJ·mol-1
D、强酸强碱的中和热为- 57.3 kJ/mol:Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) ΔH=-114.6kJ/mol
13. 下列说法错误的是( )A、化石燃料在任何条件下都能充分燃烧 B、化石燃料在燃烧过程中产生污染环境的CO、SO2等有害气体 C、直接燃烧煤不如将煤进行深加工后再燃烧的效果好 D、固体煤变为气体燃料后,燃烧效率将提高14. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
2NH3(g) △H= -73kJ/mol
C、甲烷的标准燃烧热为-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g) ΔH=-890.3kJ·mol-1
D、强酸强碱的中和热为- 57.3 kJ/mol:Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) ΔH=-114.6kJ/mol
13. 下列说法错误的是( )A、化石燃料在任何条件下都能充分燃烧 B、化石燃料在燃烧过程中产生污染环境的CO、SO2等有害气体 C、直接燃烧煤不如将煤进行深加工后再燃烧的效果好 D、固体煤变为气体燃料后,燃烧效率将提高14. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A、①②③④ B、⑤⑥⑦⑧ C、③⑤⑥⑦⑧ D、③④⑤⑥⑦⑧15. 下列观点你不赞成的是( )A、氢气让人欢喜让人忧 B、煤为人类提供能源和化工原料的同时,也埋下了祸根 C、煤气化能提高市民的生活质量,同时也是潜伏着的无形杀手 D、水虽然是取之不尽的,但个别地区存在用水危机16. 下列关于燃烧热的说法中正确的是( )A、1 mol物质燃烧所放出的热量 B、常温下,可燃物燃烧放出的热量 C、在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 D、燃烧热随化学方程式前的化学计量数的改变而改变17. 已知1 mol燃料完全燃烧的数据分别为:( )燃料
一氧化碳
甲烷
异辛烷(C8H18)
乙醇
ΔH
-283.0 kJ·mol−1
-891.0 kJ·mol−1
-5461.0 kJ·mol−1
-1366.8 kJ·mol−1
使用上述燃料最能体现“低碳经济”理念的是
A、一氧化碳 B、甲烷 C、异辛烷 D、乙醇18. 下列说法中正确的是( )A、1 mol CH4燃烧放出的热量就是燃烧热 B、1 mol C燃烧生成CO时放出的热量就是C的燃烧热 C、1 mol H2燃烧生成水放出的热量就是H2的燃烧热 D、相同条件下,1 mol H2O(l)完全分解吸收的热量与H2、O2化合生成1 mol H2O(l)放出的热量在数值上相等19. 下列各组物质的燃烧热相等的是( )A、碳和一氧化碳 B、淀粉和纤维素 C、1 mol碳和3 mol碳 D、3 mol C2H2和1 mol C6H620. 下列有关热化学方程式的叙述正确的是( )A、2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1 , 则氢气的燃烧热为241.8kJ•mol-1 B、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 C、含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O △H=-57.4kJ•mol-1 D、已知2C(s)+2O2(g)=2CO2(g) △H1 , 2C(s)+O2(g)="2CO(g)" △H2 , 则△H1<△H221. 下列热化学方程式表达正确的是( 的绝对值均正确)( ) A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热) B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热) C、S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热) D、2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
的绝对值均正确)( ) A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热) B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热) C、S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热) D、2NO2=O2+2NO △H= +116.2kJ/mol (反应热)二、填空题
-
22.(1)、在101 kPa时,足量H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为 , 表示H2燃烧热的热化学方程式为 。(2)、1.00 L 1.00 mol·L-1硫酸与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为 , 表示其中和热的热化学方程式为。23.(1)、 2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的 ΔH= -99kJ/mol。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的 ΔH= -99kJ/mol。请回答下列问题: 
①图中A点表示:;C点表示:;
E的大小对该反应的反应热(填“有”或“无”)影响。
②图中△H=kJ/mol。
(2)、由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)①写出该反应的热化学方程式: ;
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH =kJ/mol。氢气的燃烧热为ΔH =kJ/mol。
24. 根据下列两个热化学方程式,回答下列问题:2H2(g)+O2(g)= 2H2O(1) ΔH=−571.6 kJ · mol−1
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) ΔH=−2 220 kJ · mol−1
(1)、H2的燃烧热为 , C3H8的燃烧热为。(2)、1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为。(3)、现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是。25. 生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如图所示。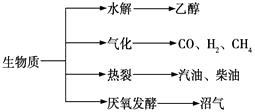 (1)、下列有关生物质能的说法正确的是。
(1)、下列有关生物质能的说法正确的是。a.生物质能本质上来源于太阳能
b.纤维素水解获得的产物中含有丰富的生物质能
c.生物质“热裂”获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,可作家庭燃气
(2)、由生物质能可获得CO和H2。等物质的量的CO与H2反应时,其原子利用率可达100%,则该反应合成的物质可能是。a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)