高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)
试卷更新日期:2018-01-16 类型:同步测试
一、选择题
-
1. 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成分判断正确的是( )
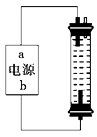 A、a为正极,b为负极;NaClO和NaCl B、a为负极,b为正极;NaClO和NaCl C、a为阳极,b为阴极;HClO和NaCl D、a为阴极,b为阳极;HClO和NaCl2. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A、阳极发生还原反应,其电极反应式:Ni2++2e-=Ni B、电解过程中,阳极质量的减少与阴极质量的增加相等 C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D、电解后,电解槽底部的阳极泥中只有Cu和Pt3. 有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一定时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )A、4∶1 B、1∶1 C、4∶3 D、3∶44. 把两支惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是( )A、27 mg B、54 mg C、108 mg D、216 mg5. 在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是( )A、都是轻金属 B、都是活泼金属 C、成本低廉 D、这些金属的化合物熔点较低6. 电解CuSO4溶液时,若要达到以下三点要求:①阳极质量减少;②阴极质量增加;③电解液中c(Cu2+)不变,则可选用的电极是( )A、含Zn、Ag的铜合金作阳极,纯铜作阴极 B、纯铜作阳极,含Zn、Ag的铜合金作阴极 C、用纯铁作阳极,用纯铜作阴极 D、用石墨作阳极,用惰性电极(Pt)作阴极7. 依据下图判断,下列叙述正确的是( )
A、a为正极,b为负极;NaClO和NaCl B、a为负极,b为正极;NaClO和NaCl C、a为阳极,b为阴极;HClO和NaCl D、a为阴极,b为阳极;HClO和NaCl2. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A、阳极发生还原反应,其电极反应式:Ni2++2e-=Ni B、电解过程中,阳极质量的减少与阴极质量的增加相等 C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D、电解后,电解槽底部的阳极泥中只有Cu和Pt3. 有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一定时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )A、4∶1 B、1∶1 C、4∶3 D、3∶44. 把两支惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是( )A、27 mg B、54 mg C、108 mg D、216 mg5. 在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是( )A、都是轻金属 B、都是活泼金属 C、成本低廉 D、这些金属的化合物熔点较低6. 电解CuSO4溶液时,若要达到以下三点要求:①阳极质量减少;②阴极质量增加;③电解液中c(Cu2+)不变,则可选用的电极是( )A、含Zn、Ag的铜合金作阳极,纯铜作阴极 B、纯铜作阳极,含Zn、Ag的铜合金作阴极 C、用纯铁作阳极,用纯铜作阴极 D、用石墨作阳极,用惰性电极(Pt)作阴极7. 依据下图判断,下列叙述正确的是( )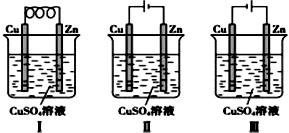 A、Ⅰ是原电池,Ⅱ是电镀装置 B、Ⅰ、Ⅱ装置中锌极上均发生氧化反应 C、Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 D、Ⅱ、Ⅲ装置中Cu2+浓度基本不变8. 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )A、原混合溶液中c(K+)为4 mol·L-1 B、上述电解过程中共转移4 mol电子 C、电解得到的Cu的物质的量为0.5 mol D、电解后溶液中c(H+)为2 mol·L-19. 用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )A、 B、 C、 D、10. 下列有关电解原理的说法中不正确的是( )A、电解饱和食盐水时,一般用铁作阳极,碳作阴极 B、电镀时,通常用待镀的金属制品作阴极,用镀层金属作阳极 C、对于冶炼像钠、钙、镁、铝等活泼的金属,电解法几乎是唯一可行的工业方法 D、电解精炼铜时,用纯铜板作阴极,粗铜板作阳极11. 工业上常用电解法冶炼的金属是( )A、钠 B、铁 C、铜 D、银12. 电解及其原理在化工生产中得到广泛应用,下列说法合理的是( )A、电镀铜时用待镀的金属制品作阳极、铜作阴极 B、AlCl3熔点低,电解熔融AlCl3冶炼铝更节能 C、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 D、氯碱工业实际是指电解饱和食盐水的工业生产13. 下列应用不涉及氧化还原反应的是( )A、Na2O2用作呼吸面具的供氧剂 B、工业上电解熔融状态的Al2O3制备Al C、工业上利用合成氨实现人工固氮 D、实验室用NH4Cl和Ca(OH)2制备NH314. 关于电解NaCl水溶液,下列叙述正确的是( )A、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 C、电解时在阳极得到氯气,在阴极得到金属钠 D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性15. 下列装置,可达到铁片上镀锌目的的是( )A、
A、Ⅰ是原电池,Ⅱ是电镀装置 B、Ⅰ、Ⅱ装置中锌极上均发生氧化反应 C、Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 D、Ⅱ、Ⅲ装置中Cu2+浓度基本不变8. 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )A、原混合溶液中c(K+)为4 mol·L-1 B、上述电解过程中共转移4 mol电子 C、电解得到的Cu的物质的量为0.5 mol D、电解后溶液中c(H+)为2 mol·L-19. 用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )A、 B、 C、 D、10. 下列有关电解原理的说法中不正确的是( )A、电解饱和食盐水时,一般用铁作阳极,碳作阴极 B、电镀时,通常用待镀的金属制品作阴极,用镀层金属作阳极 C、对于冶炼像钠、钙、镁、铝等活泼的金属,电解法几乎是唯一可行的工业方法 D、电解精炼铜时,用纯铜板作阴极,粗铜板作阳极11. 工业上常用电解法冶炼的金属是( )A、钠 B、铁 C、铜 D、银12. 电解及其原理在化工生产中得到广泛应用,下列说法合理的是( )A、电镀铜时用待镀的金属制品作阳极、铜作阴极 B、AlCl3熔点低,电解熔融AlCl3冶炼铝更节能 C、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 D、氯碱工业实际是指电解饱和食盐水的工业生产13. 下列应用不涉及氧化还原反应的是( )A、Na2O2用作呼吸面具的供氧剂 B、工业上电解熔融状态的Al2O3制备Al C、工业上利用合成氨实现人工固氮 D、实验室用NH4Cl和Ca(OH)2制备NH314. 关于电解NaCl水溶液,下列叙述正确的是( )A、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 C、电解时在阳极得到氯气,在阴极得到金属钠 D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性15. 下列装置,可达到铁片上镀锌目的的是( )A、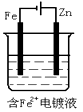 B、
B、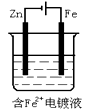 C、
C、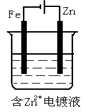 D、
D、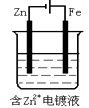 16. 下列叙述正确的是( )
16. 下列叙述正确的是( )① 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
② 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③ 电镀时,应把镀件置于电解槽的阴极
④ 冶炼铝时,用电解熔融氧化铝的方法
⑤ 钢铁表面常易锈蚀生成Fe2O3•nH2O
A、①②③④⑤ B、①③④⑤ C、①③⑤ D、②④17. 下图有关电化学的示意图正确的是( )A、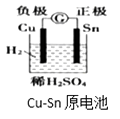 B、
B、 C、
C、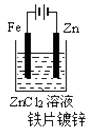 D、
D、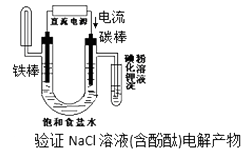 18. 如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是( )
18. 如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是( )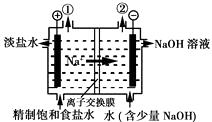 A、装置出口①处的物质是氯气 B、出口②处的物质是氢气,该离子交换膜只能让阳离子通过 C、装置中发生的反应的离子方程式2Cl−+2H+
A、装置出口①处的物质是氯气 B、出口②处的物质是氢气,该离子交换膜只能让阳离子通过 C、装置中发生的反应的离子方程式2Cl−+2H+ Cl2↑+H2↑
D、该装置是将电能转化为化学能
19. 如图所示,甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法中正确的是( )
Cl2↑+H2↑
D、该装置是将电能转化为化学能
19. 如图所示,甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法中正确的是( )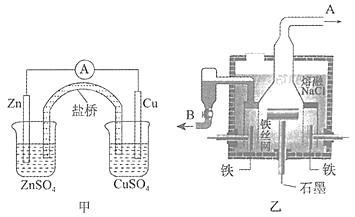 A、甲装置中锌为负极,发生还原反应,铜为正极,发生氧化反应 B、甲装置中盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性 C、乙装置中铁极的电极反应式为:2Na – 2e−=2Na+ D、乙装置中B是氯气出口,A是钠出口20. 在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是 ( )A、锌作阳极,铁制品作阴极,溶液中含Fe2+ B、锌作阴极,铁制品作阳极,溶液中含Zn2+ C、锌作阴极,铁制品作阳极,溶液中含Fe3+ D、锌作阳极,铁制品作阴极,溶液中含Zn2+21. 已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是( )A、充电时作阳极,放电时作正极 B、充电时作阳极,放电时作负极 C、充电时作阴极,放电时作负极 D、充电时作阴极,放电时作正极22. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O
A、甲装置中锌为负极,发生还原反应,铜为正极,发生氧化反应 B、甲装置中盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性 C、乙装置中铁极的电极反应式为:2Na – 2e−=2Na+ D、乙装置中B是氯气出口,A是钠出口20. 在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是 ( )A、锌作阳极,铁制品作阴极,溶液中含Fe2+ B、锌作阴极,铁制品作阳极,溶液中含Zn2+ C、锌作阴极,铁制品作阳极,溶液中含Fe3+ D、锌作阳极,铁制品作阴极,溶液中含Zn2+21. 已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是( )A、充电时作阳极,放电时作正极 B、充电时作阳极,放电时作负极 C、充电时作阴极,放电时作负极 D、充电时作阴极,放电时作正极22. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O Cu2O+H2↑。下列说法正确的是( )
Cu2O+H2↑。下列说法正确的是( ) 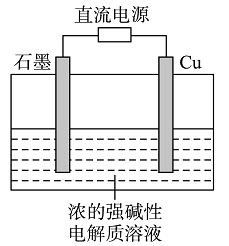 A、石墨电极上产生氢气 B、铜电极发生还原反应 C、铜电极接直流电源的负极 D、当有0.1 mol电子转移时,有0.1 mol Cu2O生成
A、石墨电极上产生氢气 B、铜电极发生还原反应 C、铜电极接直流电源的负极 D、当有0.1 mol电子转移时,有0.1 mol Cu2O生成二、填空题
-
23. 电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题。
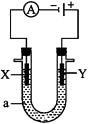
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
(1)、电解池中X极上的电极反应式是 , 在X极附近观察到的现象是。(2)、Y电极上的电极反应式是 , 检验该电极反应产物的方法是。24. 铝和氢氧化钾都是重要的工业产品。请回答:(1)、工业冶炼铝的化学方程式是。(2)、铝与氢氧化钾溶液反应的离子方程式是。(3)、工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。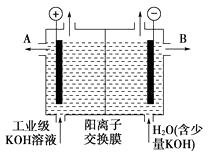
①该电解槽的阳极反应式是。
②通电开始后,阴极附近溶液pH会增大,请简述原因。
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
25. 某课外活动小组准备用如图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液: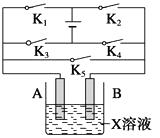
A电极
B电极
X溶液
甲
Cu
Zn
H2SO4
乙
Pt
Pt
CuCl2
丙
Fe
Cu
?
(1)、甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为;(2)、乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为;实验时应闭合的电键组合是。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2
B.K1和K3
C.K1和K4
D.K2和K3
E.K2和K4
(3)、丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为 , 实验时,应闭合的电键组合是(选项如上)。26. 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)、在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为 , 与电源负极相连的电极附近,溶液pH(选填“不变”、“升高”或“下降”)。(2)、工业食盐中含Ca2+、Mg2+等杂质,精制过程中除去这些杂质时发生反应的离子方程式为、。(3)、如果粗盐中SO42-含量过高,必须添加钡试剂除去SO42- , 该钡试剂可以是________(填写字母序号,下同)。A、Ba(OH)2 B、Ba(NO3)2 C、BaCl2(4)、为有效除去Ca2+、Mg2+、SO42- , 加入试剂的合理顺序为________。A、先加NaOH,后加Na2CO3 , 再加钡试剂 B、先加NaOH,后加钡试剂,再加Na2CO3 C、先加钡试剂,后加NaOH,再加Na2CO3(5)、脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl。(6)、用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,得到的产物仅是NaClO和H2 , 则与该反应相应的化学方程式为。27. 电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: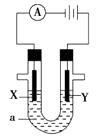 (1)、若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
(1)、若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则①电解池中Y电极上的电极反应式为。在Y电极附近观察到的实验现象是;检验该电极反应产物的方法是。
②X电极上的电极反应式为。
(2)、如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:①X电极的材料是 , 电极反应式为;
②Y极的材料是 , 电极反应式为。
28. 如图所示是某实验小组电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是石墨电极。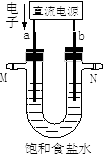 (1)、a电极的名称。(2)、电解过程中a极区域观察到的现象。(3)、电解的总反应离子方程式为。(4)、某实验小组用1.6 A电流电解6.02 min,在阴极可以生成mL(标准状况)气体(一个电子的电量为 1.6×10−19 C)。(5)、若将b电极换成铁作电极,电解一段时间后U型管底部出现红褐色沉淀,请用化学方程式解释这一现象,写出总反应的化学方程式。29. 某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中电解质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
(1)、a电极的名称。(2)、电解过程中a极区域观察到的现象。(3)、电解的总反应离子方程式为。(4)、某实验小组用1.6 A电流电解6.02 min,在阴极可以生成mL(标准状况)气体(一个电子的电量为 1.6×10−19 C)。(5)、若将b电极换成铁作电极,电解一段时间后U型管底部出现红褐色沉淀,请用化学方程式解释这一现象,写出总反应的化学方程式。29. 某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中电解质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。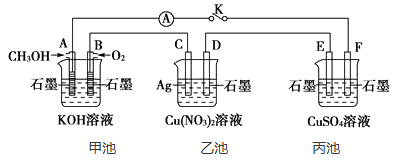
请回答下列问题:
(1)、甲池为(填“原电池”“电解池”或“电镀”),B电极的电极反应式为。(2)、丙池中F电极为(填“正极”“负极”“阴极”或“阳极),该池的总反应方程式。(3)、当乙池中C极质量减轻5.4 g时,甲池中B电极理论上消耗O2的体积为mL(标准状况), 丙池中极(填E或F)析出gCu。(4)、若丙中电极不变,将其溶液换为NaCl溶液,电键闭合一段时间后,甲中溶液的pH将(填“增大”“减小”或“不变”);丙中溶液的pH将(填“增大”“减小”或“不变”)。