高中化学人教版 选修四 第三章 水溶液中的离子反应 第一节 弱电解质的电离 弱电解质的电离
试卷更新日期:2018-01-16 类型:同步测试
一、单选题
-
1. 强弱电解质的本质区别是( )A、导电能力 B、相对分子质量 C、电离程度 D、溶解度2. 将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是( )A、醋酸的浓度达到1 mol·L-1 B、H+的浓度达到0.5 mol·L-1 C、醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol·L-1 D、醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等3. 将浓度为0.1mol/L=HF溶液加水不断稀释,下列各量始终保持增大的是( )A、c(H+) B、Ka(HF) C、
 D、
D、 4. 一元弱酸HA(aq)中存在下列电离平衡:HA
4. 一元弱酸HA(aq)中存在下列电离平衡:HA H++A- , 如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( ) A、
H++A- , 如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( ) A、 B、
B、 C、
C、 D、
D、 5. 下列有关“电离平衡”的叙述中正确的是( )A、电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 B、达到电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡 C、电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 D、电解质达到电离平衡后,各种离子的浓度相等6. 甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是( )A、常温下,1 mol/L甲酸溶液中的c(H+)约为1×10-2 mol·L-1 B、甲酸能与碳酸钠反应放出二氧化碳 C、10 mL 1 mol·L-1甲酸溶液恰好与10 mL 1 mol·L-1 NaOH溶液完全反应 D、甲酸溶液与锌反应比强酸溶液与锌反应缓慢7. c(OH-)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH-)仍相同,则m和n的关系是( )A、m>n B、m=n C、m<n D、不能确定8. 光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:
5. 下列有关“电离平衡”的叙述中正确的是( )A、电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 B、达到电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡 C、电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 D、电解质达到电离平衡后,各种离子的浓度相等6. 甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是( )A、常温下,1 mol/L甲酸溶液中的c(H+)约为1×10-2 mol·L-1 B、甲酸能与碳酸钠反应放出二氧化碳 C、10 mL 1 mol·L-1甲酸溶液恰好与10 mL 1 mol·L-1 NaOH溶液完全反应 D、甲酸溶液与锌反应比强酸溶液与锌反应缓慢7. c(OH-)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH-)仍相同,则m和n的关系是( )A、m>n B、m=n C、m<n D、不能确定8. 光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是( )
A、该溶液中存在着SO2分子 B、该溶液中H+浓度是SO32-浓度的2倍 C、向该溶液中加入足量的酸都能放出SO2气体 D、向该溶液中加入过量NaOH可得到Na2SO3、NaHSO3和NaOH的混合溶液9. 下列说法正确的是( )A、根据溶液中有CH3COOH、CH3COO-和H+即可证明CH3COOH达到电离平衡状态 B、根据溶液中CH3COO-和H+的物质的量浓度相等可证明CH3COOH达到电离平衡状态 C、当NH3·H2O达到电离平衡时,溶液中NH3·H2O、NH和OH-的浓度相等 D、H2CO3是分步电离的,电离程度依次减弱10. 在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液中,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11 , 其中氢离子浓度最小的是( )A、HNO2 B、HCOOH C、HCN D、H2CO311. 在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )A、加热 B、加入100 mL 0.1 mol·L-1的醋酸溶液 C、加入少量的0.5 mol·L-1的硫酸 D、加入少量的1 mol·L-1的NaOH溶液12. 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2=HCN+NaNO2 , ②NaCN+HF=HCN+NaF,③NaNO2+HF=HNO2+NaF。由此可判断下列叙述中,不正确的是( )A、HF的电离平衡常数为7.2×10-4 B、HNO2的电离平衡常数为4.9×10-10 C、根据①③两个反应即可知三种酸的相对强弱 D、HNO2的电离平衡常数比HCN大,比HF小二、填空题
-
13. 在a、b两支试管中,分别装入形态相同、质量相等的锌粒,然后向两试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:(1)、a、b两支试管中的现象;相同点是;不同点是;原因是。(2)、a、b两支试管中生成气体的体积开始时是V(a)V(b);反应完毕后生成气体的总体积是V(a)V(b),原因是。14. 下表是几种常见弱酸的电离平衡常数(25 ℃)
酸
电离方程式
电离平衡常数K
CH3COOH
CH3COOH
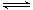 CH3COO-+H+
CH3COO-+H+1.76×10-5
H2CO3
H2CO3
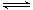 H++HCO3-
H++HCO3-HCO3-
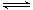 H++CO32-
H++CO32-K1=4.4×10-7
K2=4.7×10-11
H2S
H2S
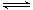 H++HS-
H++HS-HS-
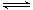 H++S2-
H++S2-K1=1.3×10-7
K2=7.1×10-15
H3PO4
H3PO4
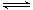 H++H2PO4-
H++H2PO4-H2PO4-
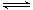 H++HPO42-
H++HPO42-HPO42-
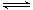 H++PO43-
H++PO43-K1=7.1×10-3
K2=6.3×10-8
K3=4.20×10-13
回答下列问题:
(1)、当温度升高时,K值(填“增大”“减小”或“不变)。(2)、在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?。(3)、若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 , 最弱的是。(4)、多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是 , 产生此规律的原因是。