高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第一课时(可逆反应)
试卷更新日期:2018-01-15 类型:同步测试
一、选择题
-
1. 下列有关可逆反应的说法不正确的是( )A、可逆反应是指在同一条件下能同时向正逆两个方向进行的反应 B、2HI H2+I2是可逆反应 C、CaCO3 CaO+CO2↑是可逆反应 D、存在平衡的不一定是化学反应2. 298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g)
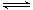 2NH3(g) ΔH=-92.4 kJ/mol,在该温度下,取1 mol N2和3 mol H2放在密闭容器内反应。下列说法正确的是( ) A、在有催化剂存在的条件下,反应放出的热量为92.4 kJ B、有无催化剂该反应放出的热量都为92.4 kJ C、反应放出的热量始终小于92.4 kJ D、若再充入1 mol H2 , 到达平衡时放出的热量应为92.4 kJ3. 如图是可逆反应X2+3Y2
2NH3(g) ΔH=-92.4 kJ/mol,在该温度下,取1 mol N2和3 mol H2放在密闭容器内反应。下列说法正确的是( ) A、在有催化剂存在的条件下,反应放出的热量为92.4 kJ B、有无催化剂该反应放出的热量都为92.4 kJ C、反应放出的热量始终小于92.4 kJ D、若再充入1 mol H2 , 到达平衡时放出的热量应为92.4 kJ3. 如图是可逆反应X2+3Y2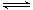 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )  A、t1时,只有正方向反应 B、0~t1 , c(Z)在减小 C、t2~t3 , 反应不再进行 D、t2~t3 , 各物质的浓度不再发生变化4. 能够说明一个可逆反应H2(g)+I2(g)
A、t1时,只有正方向反应 B、0~t1 , c(Z)在减小 C、t2~t3 , 反应不再进行 D、t2~t3 , 各物质的浓度不再发生变化4. 能够说明一个可逆反应H2(g)+I2(g)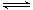 2HI(g)已达到平衡状态的是( ) A、1 mol H—H键断裂的同时有1 mol H—I键形成 B、1 mol H—H键断裂的同时有2 mol H—I键形成 C、1 mol I—I键断裂的同时有2 mol HI键形成 D、1 mol H—H键断裂的同时有1 mol I—I键形成5. 可逆反应2HI(g)
2HI(g)已达到平衡状态的是( ) A、1 mol H—H键断裂的同时有1 mol H—I键形成 B、1 mol H—H键断裂的同时有2 mol H—I键形成 C、1 mol I—I键断裂的同时有2 mol HI键形成 D、1 mol H—H键断裂的同时有1 mol I—I键形成5. 可逆反应2HI(g)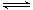 H2(g)+I2(g)在密闭容器中进行,下列能说明该反应已达到平衡状态的是( ) A、容器内压强不随时间变化而变化 B、混合气体总分子数不随时间变化而变化 C、混合气体的颜色不再改变 D、c(H2)与c(I2)保持相等6. 在一定条件下,反应:2NO+O2
H2(g)+I2(g)在密闭容器中进行,下列能说明该反应已达到平衡状态的是( ) A、容器内压强不随时间变化而变化 B、混合气体总分子数不随时间变化而变化 C、混合气体的颜色不再改变 D、c(H2)与c(I2)保持相等6. 在一定条件下,反应:2NO+O2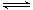 2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是( ) A、混合气体的总分子数不再变化 B、混合气体的颜色不再变化 C、容器的总压强不再变化 D、混合气体的总质量不再变化7. 在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是( )A、反应开始时,正反应速率最大,逆反应速率为零 B、随着反应的进行,正反应速率逐渐减小,最后为零 C、随着反应的进行,逆反应速率逐渐增大,最后不变 D、随着反应的进行,正反应速率逐渐减小,最后不变8. 在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )A、只存在于氧气中 B、只存在于SO3中 C、只存在于SO2和SO3中 D、SO2、SO3、O2中都存在9. 3 mol H2和1 mol N2放入密闭容器中,使用催化剂发生反应:N2+3H2
2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是( ) A、混合气体的总分子数不再变化 B、混合气体的颜色不再变化 C、容器的总压强不再变化 D、混合气体的总质量不再变化7. 在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是( )A、反应开始时,正反应速率最大,逆反应速率为零 B、随着反应的进行,正反应速率逐渐减小,最后为零 C、随着反应的进行,逆反应速率逐渐增大,最后不变 D、随着反应的进行,正反应速率逐渐减小,最后不变8. 在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )A、只存在于氧气中 B、只存在于SO3中 C、只存在于SO2和SO3中 D、SO2、SO3、O2中都存在9. 3 mol H2和1 mol N2放入密闭容器中,使用催化剂发生反应:N2+3H2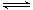 2NH3 , 从反应开始到平衡过程中,不可能出现的是( ) A、2 mol NH3 B、0.5 mol NH3 C、0.9 mol N2 D、H2和NH3物质的量相等10. 可逆反应aA(g)+bB(g)
2NH3 , 从反应开始到平衡过程中,不可能出现的是( ) A、2 mol NH3 B、0.5 mol NH3 C、0.9 mol N2 D、H2和NH3物质的量相等10. 可逆反应aA(g)+bB(g)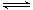 cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( ) A、av正(A)=bv正(B) B、bv正(A)=av逆(B) C、av正(C)=cv正(A) D、av正(A)=bv逆(B)11. 把HI气体充入密闭容器中,在一定条件下发生反应2HI(g)
cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( ) A、av正(A)=bv正(B) B、bv正(A)=av逆(B) C、av正(C)=cv正(A) D、av正(A)=bv逆(B)11. 把HI气体充入密闭容器中,在一定条件下发生反应2HI(g)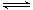 H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( ) A、HI的生成速率等于其分解速率 B、HI的生成速率小于其分解速率 C、HI的生成速率大于其分解速率 D、无法判断HI的生成速率和分解速率的相对大小12. 可逆反应达到平衡的根本原因是( )A、反应混合物中各组分的浓度相等 B、正、逆反应都还在继续进行 C、正、逆反应的速率均为零 D、正、逆反应的速率相等13. 下列有关反应限度的说法正确的是( )A、大多数化学反应在一定条件下都有一定的限度 B、NH4HCO3受热分解可自发进行: C、使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 D、FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深14. 可确认发生了化学平衡移动的是( )A、化学反应速率发生了改变 B、有气态物质参加的可逆反应达到平衡后,改变了压强 C、某一条件的改变,使正、逆反应速率不再相等 D、可逆反应达到平衡后,使用了催化剂15. 在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(g)+2B(g) C(g)+2D(g)已达到平衡状态( )A、混合气体的压强 B、混合气体的密度 C、各气体的物质的量 D、气体的总物质的量16. 对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是( )A、达到化学平衡状态时,4v正(O2)= 5v逆(NO) B、若单位时间内生成x mol NO的同时,消耗x mol NH3 , 则反应达到化学平衡状态 C、达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大 D、化学反应速率的关系为2v正(NH3)= 3v正(H2O)17. 在一定条件下,将3 mol N2和3 mol H2充入一个容积固定的密闭容器中,发生反应:N2(g)+3H2(g)
H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( ) A、HI的生成速率等于其分解速率 B、HI的生成速率小于其分解速率 C、HI的生成速率大于其分解速率 D、无法判断HI的生成速率和分解速率的相对大小12. 可逆反应达到平衡的根本原因是( )A、反应混合物中各组分的浓度相等 B、正、逆反应都还在继续进行 C、正、逆反应的速率均为零 D、正、逆反应的速率相等13. 下列有关反应限度的说法正确的是( )A、大多数化学反应在一定条件下都有一定的限度 B、NH4HCO3受热分解可自发进行: C、使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 D、FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深14. 可确认发生了化学平衡移动的是( )A、化学反应速率发生了改变 B、有气态物质参加的可逆反应达到平衡后,改变了压强 C、某一条件的改变,使正、逆反应速率不再相等 D、可逆反应达到平衡后,使用了催化剂15. 在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(g)+2B(g) C(g)+2D(g)已达到平衡状态( )A、混合气体的压强 B、混合气体的密度 C、各气体的物质的量 D、气体的总物质的量16. 对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是( )A、达到化学平衡状态时,4v正(O2)= 5v逆(NO) B、若单位时间内生成x mol NO的同时,消耗x mol NH3 , 则反应达到化学平衡状态 C、达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大 D、化学反应速率的关系为2v正(NH3)= 3v正(H2O)17. 在一定条件下,将3 mol N2和3 mol H2充入一个容积固定的密闭容器中,发生反应:N2(g)+3H2(g) 2NH3(g)。当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中不正确的是( )
2NH3(g)。当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中不正确的是( ) 选项
起始状态/mol
N2
H2
NH3
A
2
0
2
B
2.5
1.5
1
C
2
D
0
0
2
A、A B、B C、C D、D18. 模型法是化学中把微观问题宏观化的最常见方法,对于2HBr(g) H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是( )
H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是( )  A、A B、B C、C D、D19. 一定温度下,可逆反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是:( )A、单位时间内生成 n mol A2 , 同时生成 n mol AB B、体系内的总压不随时间变化 C、单位时间内生成2n mol AB的同时生成n mol B2 D、单位时间内生成 n mol A2的同时,生成n mol B220. 对可逆反应2SO2+O2 2SO3 , 在混合气体中充入一定量的18O2 , 足够长的时间后, 18O原子()A、只存在于O2中 B、只存在于O2和SO3中 C、只存在于O2和SO2中 D、存在于O2、SO2和SO3中21. 在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)=C(g)+D(g)已达到平衡状态
A、A B、B C、C D、D19. 一定温度下,可逆反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是:( )A、单位时间内生成 n mol A2 , 同时生成 n mol AB B、体系内的总压不随时间变化 C、单位时间内生成2n mol AB的同时生成n mol B2 D、单位时间内生成 n mol A2的同时,生成n mol B220. 对可逆反应2SO2+O2 2SO3 , 在混合气体中充入一定量的18O2 , 足够长的时间后, 18O原子()A、只存在于O2中 B、只存在于O2和SO3中 C、只存在于O2和SO2中 D、存在于O2、SO2和SO3中21. 在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)=C(g)+D(g)已达到平衡状态①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值⑦混合气体总质量⑧混合气体总体积( )
A、①②③④⑤⑥⑦⑧ B、①③④⑤ C、①②③④⑤⑦ D、①③④⑤⑧二、填空题
-
22. 689 K时,在1 L密闭容器中进行的反应:H2(g)+I2(g)
 2HI(g)达到平衡,图甲表示当起始物为1 mol·L-1 H2和1 mol·L-1 I2时,容器内各物质的浓度c的变化与时间t的关系示意图。
2HI(g)达到平衡,图甲表示当起始物为1 mol·L-1 H2和1 mol·L-1 I2时,容器内各物质的浓度c的变化与时间t的关系示意图。  (1)、请在图乙中画出当起始物为2 mol·L-1 HI时,容器中各物质的浓度变化与时间的关系示意图。(2)、由图中的事实说明化学平衡具有的特征是。23. 在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)⇋2HI(g)。(1)、反应刚开始时,由于c(H2)= , c(I2)= , 而c(HI)= , 所以化学反应速率最大而最小(为零)(填“v正”或“v逆”)。(2)、随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2) , c(I2) , 而c(HI) , 从而化学反应速率v正 , 而v逆(填“增大”、“减小”或“不变”)。(3)、当反应进行到v正与v逆时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将。24. 某研究性小组决定用实验探究的方法证明化学反应具有一定的限度,在一定条件下会达到“平衡状态”。
(1)、请在图乙中画出当起始物为2 mol·L-1 HI时,容器中各物质的浓度变化与时间的关系示意图。(2)、由图中的事实说明化学平衡具有的特征是。23. 在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)⇋2HI(g)。(1)、反应刚开始时,由于c(H2)= , c(I2)= , 而c(HI)= , 所以化学反应速率最大而最小(为零)(填“v正”或“v逆”)。(2)、随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2) , c(I2) , 而c(HI) , 从而化学反应速率v正 , 而v逆(填“增大”、“减小”或“不变”)。(3)、当反应进行到v正与v逆时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将。24. 某研究性小组决定用实验探究的方法证明化学反应具有一定的限度,在一定条件下会达到“平衡状态”。取5 mL 0.1 mol/L KI溶液于试管中,滴加0.1 mol/L FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4振荡,发现CCl4层显浅紫色,证明萃取到I2 , 即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)、老师指出他们上述实验中①不合理,你认为是;改进的方法是。(2)、有人认为步骤②适合检验生成I2较多的情况,还有一种简便方法可以灵敏地检验是否生成了I2 , 这种方法是。25. 将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应: 2H2O(g) 2H2+O2 , 2CO+O2 2CO2。(1)、当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是和 , 或和。(填它们的分子式)(2)、若平衡时O2和CO2的物质的量分别为:n平(O2)= a mol, n平(CO2)=bmol。试求n平(H2O)=。(用含a、b的代数式表示)26.(1)、有效“减碳”的手段之一是节能,下列制氢方法最节能的是(填序号)。a.电解水制氢:2H2O 2H2↑+O2↑
b.高温使水分解制氢:2H2O(g) 2H2+O2
c.太阳光催化分解水制氢:2H2O
 2H2↑+O2↑
2H2↑+O2↑d.天然气制氢:CH4+H2O(g) CO+3H2
(2)、CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2 , 一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
①从1 min到6 min,v(H2)=mol·L−1·min−1。
②能说明上述反应达到平衡状态的是(填编号)。
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3 mol H2 , 同时生成1 mol H2O
e.反应中CO2与H2的物质的量之比为1∶3且保持不变