北京市海淀区2016-2017学年高三上学期化学期末考试试卷
试卷更新日期:2018-01-06 类型:期末考试
一、单选题
-
1. 我国酒文化源远流长.下列古法酿酒工艺中,以发生化学反应为主的过程是( )A、
 酒曲捣碎
B、
酒曲捣碎
B、 酒曲发酵
C、
酒曲发酵
C、 高温蒸馏
D、
高温蒸馏
D、 泉水勾兑
2. 下列说法不正确的是( )A、碘酒可使蛋白质变性,故能消毒杀菌 B、天然氨基酸能溶于强酸或强碱溶液,是两性化合物 C、食盐、糖、醋可作调味剂,不可用作食品防腐剂 D、船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐3. 已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )A、8838Sr的中子数为38 B、最高化合价为+2 C、原子半径:Sr > Ca D、氢氧化物为强碱4. 某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。( )
泉水勾兑
2. 下列说法不正确的是( )A、碘酒可使蛋白质变性,故能消毒杀菌 B、天然氨基酸能溶于强酸或强碱溶液,是两性化合物 C、食盐、糖、醋可作调味剂,不可用作食品防腐剂 D、船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐3. 已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )A、8838Sr的中子数为38 B、最高化合价为+2 C、原子半径:Sr > Ca D、氢氧化物为强碱4. 某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。( )序号
试剂
实验现象

a
品红溶液
红色褪去
b
酸性KMnO4溶液
紫色褪去
c
NaOH溶液(含2滴酚酞)
红色褪去
下列说法正确的是
A、浓硫酸与Na2SO3固体发生了氧化还原反应 B、a、b均表明SO2具有漂白性 C、c中只可能发生反应:SO2+ 2OH—= SO32-+ H2O D、c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32-) +c(HSO3−) + c(OH−)5. 下列污水处理的方法中,表示其原理的离子方程式不正确的是( )A、混凝法,用明矾做混凝剂:Al3++3H2O Al(OH)3+3H+
B、中和法,用过量CO2中和碱性废水:CO2+2OH-=CO32-
C、沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
D、氧化还原法,用FeSO4将酸性废水中Cr2O72—还原为Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
6. 生活中常见的荧光棒的发光原理可用下式表示:
Al(OH)3+3H+
B、中和法,用过量CO2中和碱性废水:CO2+2OH-=CO32-
C、沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
D、氧化还原法,用FeSO4将酸性废水中Cr2O72—还原为Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
6. 生活中常见的荧光棒的发光原理可用下式表示: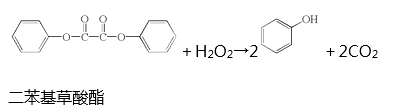
上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光。下列说法正确的是( )
A、上述反应是酯的水解反应 B、荧光棒发光过程涉及化学能到光能的转化 C、二苯基草酸酯苯环上的一氯代物共有4种 D、二苯基草酸酯与草酸(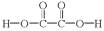 )互为同系物
7. 为了从海带浸取液中提取碘,某同学设计了如下实验方案:( )
)互为同系物
7. 为了从海带浸取液中提取碘,某同学设计了如下实验方案:( )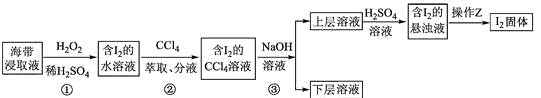
下列说法正确的是
A、①中反应的离子方程式:2I− + H2O2 = I2 + 2OH− B、②中分液时含I2的CCl4溶液从分液漏斗上口倒出 C、③中得到的上层溶液中含有I− D、操作Z的名称是加热8. 某同学利用右图所示装置制备乙酸乙酯。实验如下:( )
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A、①中加热利于加快酯化反应速率,故温度越高越好 B、③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致 C、③中红色褪去的原因可能是酚酞溶于乙酸乙酯中 D、取②中上层油状液体测其,共有3组峰9. 室温下,向0.01 mol·L−1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如右图所示。下列分析正确的是( ) A、a点,pH = 2 B、b点,c(CH3COO-) > c(NH4+) C、c点,pH可能大于7 D、ac段,溶液pH增大是CH3COOH
A、a点,pH = 2 B、b点,c(CH3COO-) > c(NH4+) C、c点,pH可能大于7 D、ac段,溶液pH增大是CH3COOH H+ + CH3COO-逆向移动的结果
10. 某同学进行下列实验:( )
H+ + CH3COO-逆向移动的结果
10. 某同学进行下列实验:( )操作
现象
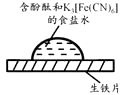
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水

放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
下列说法不合理的是
A、生铁片发生吸氧腐蚀 B、中心区:Fe–2e-=Fe2+ C、边缘处:O2+2H2O+4e-=4OH- D、交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+11. 密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:i.CO(g)+2H2(g)
 CH3OH(g) ∆H1=−90.1kJ·mol−1
CH3OH(g) ∆H1=−90.1kJ·mol−1ii.2CH3OH(g)
 CH3OCH3(g)+H2O(g) ∆H2=−24.5kJ·mol−1
CH3OCH3(g)+H2O(g) ∆H2=−24.5kJ·mol−1当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是( )
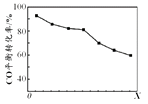 A、由H2和CO直接制备二甲醚的反应为放热反应 B、条件X为压强 C、X增大,二甲醚的产率一定增大 D、X增大,该反应的平衡常数一定减小12. 新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—
A、由H2和CO直接制备二甲醚的反应为放热反应 B、条件X为压强 C、X增大,二甲醚的产率一定增大 D、X增大,该反应的平衡常数一定减小12. 新制氢氧化铜存在平衡:Cu(OH)2 + 2OH— Cu(OH)42—(深蓝色)。某同学进行下列实验:( )
Cu(OH)42—(深蓝色)。某同学进行下列实验:( )
下列说法不正确的是
A、①中出现蓝色沉淀 B、③中现象是Cu(OH)2 + 2OH— Cu(OH)42—正向移动的结果
C、④中现象证明葡萄糖具有还原性
D、对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
13. 工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s) + CO32-(aq)
Cu(OH)42—正向移动的结果
C、④中现象证明葡萄糖具有还原性
D、对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
13. 工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s) + CO32-(aq) PbCO3(s) + SO42-(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是( ) A、PbSO4的溶解度小于PbCO3 B、处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高 C、若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4 , Na2CO3溶液中的PbSO4转化率较大 D、整个过程涉及一个复分解反应和两个氧化还原反应14. 2016年我国科研人员研制出一种室温“可呼吸”Na−CO2电池。放电时该电池“吸入”CO2 , 充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:( )
PbCO3(s) + SO42-(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是( ) A、PbSO4的溶解度小于PbCO3 B、处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高 C、若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4 , Na2CO3溶液中的PbSO4转化率较大 D、整个过程涉及一个复分解反应和两个氧化还原反应14. 2016年我国科研人员研制出一种室温“可呼吸”Na−CO2电池。放电时该电池“吸入”CO2 , 充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:( )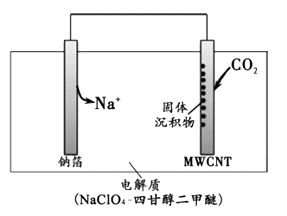 A、“吸入”CO2时,钠箔为正极 B、“呼出”CO2时,Na+向多壁碳纳米管电极移动 C、“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e-= 2Na2CO3 + C D、标准状况下,每“呼出”22.4LCO2 , 转移电子数为0.75mol
A、“吸入”CO2时,钠箔为正极 B、“呼出”CO2时,Na+向多壁碳纳米管电极移动 C、“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e-= 2Na2CO3 + C D、标准状况下,每“呼出”22.4LCO2 , 转移电子数为0.75mol二、实验题
-
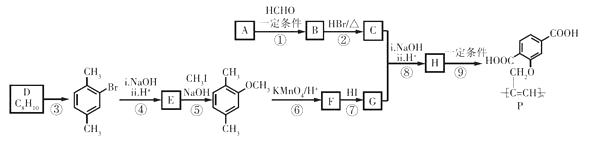
15. 功能高分子P可用作光电材料,其合成路线如下:
已知:
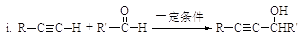 (R、R’表示氢或烃基)
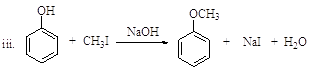
(R、R’表示氢或烃基)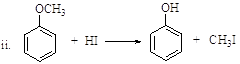
 (1)、烃A的相对分子质量是26,其结构简式是。(2)、反应①的反应类型是。(3)、C中含有的官能团是。(4)、D为苯的同系物,反应③的化学方程式是。(5)、G的结构简式是。(6)、反应⑨的化学方程式是。(7)、反应⑤和⑦的目的是。(8)、以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。16. 为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)、配制50 mL 1.0 mol·L−1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L−1。
(1)、烃A的相对分子质量是26,其结构简式是。(2)、反应①的反应类型是。(3)、C中含有的官能团是。(4)、D为苯的同系物,反应③的化学方程式是。(5)、G的结构简式是。(6)、反应⑨的化学方程式是。(7)、反应⑤和⑦的目的是。(8)、以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。16. 为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)、配制50 mL 1.0 mol·L−1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L−1。①用化学用语解释FeCl3溶液呈酸性的原因:。
②下列实验方案中,能使FeCl3溶液pH升高的是(填字母序号)。
a.加水稀释 b. 加入FeCl3固体
c.滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)、小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:操作
现象
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L−1的FeCl3溶液,搅拌
溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体
收集检验反应过程中产生的气体
集气管口靠近火焰,有爆鸣声
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:。
② 用离子方程式解释反应后溶液为浅绿色的原因:。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4 , 理由是。
(3)、为进一步探究上述1.0 mol·L−1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:操作
现象
将5 mL 1.0 mol·L−1的FeCl3溶液与0.65 g锌粉混合
溶液温度迅速上升,开始时几乎没有气泡
将与0.65 g锌粉混合
溶液中立即产生大量气泡
小组同学得出结论:在1.0 mol·L−1 FeCl3溶液中,Fe3+的氧化性比H+更强。
17. 某小组同学利用下图装置对电解氯化铜实验进行了研究。装置
现象

电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色
(1)、甲认为电解过程中阳极产生的是溶液变绿的原因,写出产生该物质的电极反应式:。(2)、乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl [CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因:。(3)、丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。装置
现象
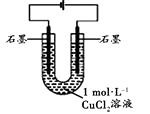
电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是 , 否定乙的依据是。
(4)、丙继续查阅资料:i. 电解CuCl2溶液时可能产生[CuCl2]_ , [CuCl2]_掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]_的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是。
② 写出b中生成[CuCl2]_的离子方程式:。
③ 补充c中必要的操作及现象:。
丙据此得出结论:电解时阴极附近生成[CuCl2]_是导致溶液变绿的原因。
三、填空题
-
18. 一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
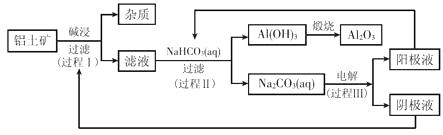 (1)、过程I,发生反应的离子方程式是。(2)、过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
(1)、过程I,发生反应的离子方程式是。(2)、过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是。
② 过程II生成Al(OH)3的离子方程式是。
(3)、过程III,电解Na2CO3溶液的装置如下图所示。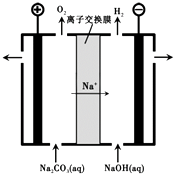
①阴极的电极反应式是。
②简述阳极液生成的原理:。
19. H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。(1)、H2O2溶液显弱酸性,测得0.15 mol·L−1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式:。(2)、其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下: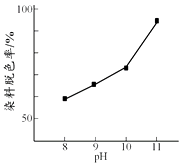
由上图可得到的结论是 , 结合平衡移动原理简述理由:。
(3)、实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L−1 的H2O2溶液发生分解反应,结果如下:初始pH
pH = 10
pH = 12
1小时后H2O2溶液浓度
0.13 mol·L−1
0.07 mol·L−1
1小时后pH
没有明显变化
没有明显变化
查阅资料:HO2-+H2O2=H2O+O2+OH-。
①结合离子方程式解释1小时后pH没有明显变化的原因:。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:。