北京市昌平区2016-2017学年高三上学期化学期末考试试卷
试卷更新日期:2018-01-06 类型:期末考试
一、单选题
-
1. 化学与人类生产、生活密切相关,下列说法不正确的是( )A、计算机芯片的主要材料是Si B、明矾能使海水淡化从而解决淡水危机 C、可用碘酒灭菌消毒是因为它能使蛋白质变性 D、钠、锶、钡等金属化合物可在燃放时呈现艳丽色彩2. 常温下,下列各组离子能大量共存的是( )A、H+、Na+、SO42﹣、Cu2+ B、Na+、NH4+、H+、CO32﹣ C、K+、Fe2+、H+、NO3﹣ D、Ca2+、Ba2+、SO42﹣、Cl﹣3. 下列化学用语正确的是( )A、硫离子的结构示意图:
 B、FeSO3的名称是亚硫酸铁
C、电子转移情况:
B、FeSO3的名称是亚硫酸铁
C、电子转移情况: 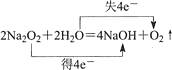 D、氮气分子的电子式:
D、氮气分子的电子式:  4. 钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为:TiO2+2C+2Cl2
4. 钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为:TiO2+2C+2Cl2 TiCl4+2CO。下列关于该反应的说法正确的是( ) A、TiO2是氧化剂 B、四氯化钛是还原产物 C、Cl2发生氧化反应 D、氧化剂与还原剂的物质的量之比为1:25. “一滴香”是有毒物质,被人食用后会损伤肝脏还能致癌。其分子结构如图所示,下列说法正确的是( )
TiCl4+2CO。下列关于该反应的说法正确的是( ) A、TiO2是氧化剂 B、四氯化钛是还原产物 C、Cl2发生氧化反应 D、氧化剂与还原剂的物质的量之比为1:25. “一滴香”是有毒物质,被人食用后会损伤肝脏还能致癌。其分子结构如图所示,下列说法正确的是( ) A、该有机物的分子式为C7H7O3 B、该有机物能发生取代、加成和氧化反应 C、1mol该有机物最多能与2mol H2发生加成反应 D、该有机物的一种含苯环的同分异构体能发生银镜反应6. 下列离子方程式不正确的是( )A、FeCl3溶液腐蚀铜印刷电路板:2Fe3++Cu=2Fe2++Cu2+ B、硫酸铝溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O C、浓NaOH溶液处理少量二氧化硫:SO2+ OH-= HSO3- D、盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-=SiO32-+H2O7. NA代表阿伏加德罗常数,下列说法正确的是( )A、3.2gO2和O3的混合物中含有的氧原子数目为0.2NA B、1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA C、标准状况下,2.24LCCl4含碳原子数目为0.1NA D、将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L8. 关于下图所示两个装置的叙述中不正确的是( )
A、该有机物的分子式为C7H7O3 B、该有机物能发生取代、加成和氧化反应 C、1mol该有机物最多能与2mol H2发生加成反应 D、该有机物的一种含苯环的同分异构体能发生银镜反应6. 下列离子方程式不正确的是( )A、FeCl3溶液腐蚀铜印刷电路板:2Fe3++Cu=2Fe2++Cu2+ B、硫酸铝溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O C、浓NaOH溶液处理少量二氧化硫:SO2+ OH-= HSO3- D、盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-=SiO32-+H2O7. NA代表阿伏加德罗常数,下列说法正确的是( )A、3.2gO2和O3的混合物中含有的氧原子数目为0.2NA B、1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA C、标准状况下,2.24LCCl4含碳原子数目为0.1NA D、将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L8. 关于下图所示两个装置的叙述中不正确的是( ) A、c(H+)浓度变化:①减小,②减小 B、装置名称:①是电解池,②是原电池 C、离子移动方向:①中H+向阴极方向移动,②中H+向正极方向移动 D、电极反应式:①中阳极:2H2O-4e-=4H++O2↑,②中负极中Zn+2e-=Zn2+9. N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g):
A、c(H+)浓度变化:①减小,②减小 B、装置名称:①是电解池,②是原电池 C、离子移动方向:①中H+向阴极方向移动,②中H+向正极方向移动 D、电极反应式:①中阳极:2H2O-4e-=4H++O2↑,②中负极中Zn+2e-=Zn2+9. N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g):
下列说法不正确的是( )
A、Ⅰ过程中破坏的均为非极性键 B、Ⅰ过程吸收能量,II过程放出能量 C、N2(g) + 3H2(g) 2NH3(g) ΔH = –44 kJ·mol-1 D、1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高10. 已知可用Co2O3代替MnO2制备Cl2 , 反应后Co元素以 Co2+的形式存在。下列叙述不正确的是( )A、该反应中氧化性:Co2O3>Cl2 B、参加反应的HCl全部被Co2O3氧化 C、每生成1摩尔氯气,消耗1摩尔Co2O3 D、制备相同量的氯气,所需Co2O3质量比MnO2多11. 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗。其制备过程如图所示、下列叙述不合理的是( ) A、在反应②中,
A、在反应②中, 的作用可能是促进氯化铁水解
B、反应③的化学方程式是:6FeOOH + CO =2Fe3O4+3H2O+CO2
C、直接加热FeCl3溶液也可以得到四氧化三铁
D、纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象
12. 下列关于如图装置说法中正确的是( )
的作用可能是促进氯化铁水解
B、反应③的化学方程式是:6FeOOH + CO =2Fe3O4+3H2O+CO2
C、直接加热FeCl3溶液也可以得到四氧化三铁
D、纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象
12. 下列关于如图装置说法中正确的是( ) A、精炼铜时,a极为粗铜,b极为精铜 B、电镀铜时,a极为镀件,b极为铜 C、保护铁时,a极为铁片,b极为锌片 D、惰性电极电解饱和食盐水时,b极有黄绿色气体产生13. 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
A、精炼铜时,a极为粗铜,b极为精铜 B、电镀铜时,a极为镀件,b极为铜 C、保护铁时,a极为铁片,b极为锌片 D、惰性电极电解饱和食盐水时,b极有黄绿色气体产生13. 利用如图所示装置进行下列实验,能得出相应实验结论的是( )选项
①
②
③
实验结论

A
浓盐酸
Na2CO3
Na2SiO3溶液
非金属性: C>Si
B
食盐水
电石
溴水
乙炔可与溴发生加成反应
C
浓硝酸
Al
NaOH溶液
铝和浓硝酸反应可生成NO2
D
浓硫酸
Na2SO3
KMnO4酸性溶液
SO2具有还原性
A、A B、B C、C D、D14. 在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
n(N)
①
800
0.10
0.40
0.080
0.080
②
800
0.20
0.80
a
a
③
900
0.10
0.15
0.06
0.06
下列说法不正确的是:( )
A、实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L·min) B、实验②中,该反应的平衡常数K=12.5 C、实验②中,达到平衡时,a大于0.16 D、正反应为放热反应二、填空题
-
15. 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示:
 (1)、HB溶液体积稀释到1000毫升时,溶液中c(H+)=mol/L。(2)、由图可判断:HA的酸性(填“>”或“<”)HB的酸性。(3)、pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明。16. 分部分短周期元素化合价与原子序数的关系可用下图表示。
(1)、HB溶液体积稀释到1000毫升时,溶液中c(H+)=mol/L。(2)、由图可判断:HA的酸性(填“>”或“<”)HB的酸性。(3)、pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明。16. 分部分短周期元素化合价与原子序数的关系可用下图表示。 (1)、写出Q的元素符号 , 其原子结构示意图是。(2)、写出X、Z形成的化合物与Y的最高价氧化物对应的水化物反应的离子方程式;(3)、写出两种W的含氧酸的化学式、 , 请设计一种实验方案比较两种酸的酸性强弱。17. 在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
(1)、写出Q的元素符号 , 其原子结构示意图是。(2)、写出X、Z形成的化合物与Y的最高价氧化物对应的水化物反应的离子方程式;(3)、写出两种W的含氧酸的化学式、 , 请设计一种实验方案比较两种酸的酸性强弱。17. 在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:温度/ ℃
700
800
830
1000
1200
平衡常数
1.7
1.1
K
0.6
0.4
回答下列问题:
(1)、△H 0(填“<”或 “>”)。(2)、830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)、判断该反应是否达到平衡的依据为a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)、1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为。三、实验题
-
18. 氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
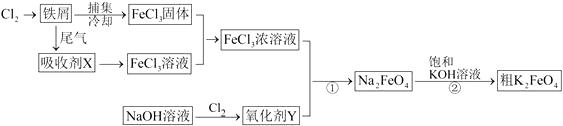
请回答下列问题:
(1)、氯化铁做净水剂的原因是(结合化学用语表达)。(2)、吸收剂X的化学式为 , 氧化剂Y的化学式为。(3)、碱性条件下反应①的离子方程式为。(4)、过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因。(5)、K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用(填序号)。A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)、高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。19. 某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。(1)、小组同学先进行理论预测,提出如下三种可能:a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生反应
c.Fe3+与 S2-发生互促水解反应
依据预测a 写出该反应的离子方程式
(2)、将预测b补充完整 , 说明预测依据。在进行实验验证前,先进行资料收集,得到如下信息:
物质
颜色
水中溶解性
Fe2S3
黑色
难溶于水
FeS
黑褐色
难溶于水
进行如下实验:
实验步骤
操作
现象
备注
①
向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液
产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象
自始至终都未见红褐色沉淀
②
继续滴加3滴0.1 mol/L 硫化钠溶液
同上
③
继续滴加0.1 mol/L 硫化钠溶液至过量
产生黑色沉淀,振荡后静置,未发现明显变化
(3)、写出黑色沉淀转变为黄色沉淀的离子方程式为进一步探究反应实质,该组同学进行了如下实验:
实验步骤
操作
现象
④
向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液
产生黑色沉淀,未见其它明显现象
⑤
继续滴加3滴0.1 mol/L 氯化铁溶液
同上
⑥
继续滴加0.1 mol/L 氯化铁溶液至过量
同上
(4)、步骤4与步骤1现象不同的原因可能是(5)、有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由(6)、依据以上实验现象,可得出结论:。20. 聚酯纤维F 和维纶J的合成路线如下:
已知:
①乙烯醇不稳定,会迅速转化为乙醛
②CH2=CH2 +1/2O2 + CH3COOH
 CH2=CHOOCCH3 + H2O
CH2=CHOOCCH3 + H2O③
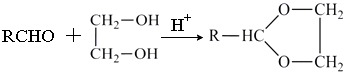 +H2O(1)、G中官能团的名称是(2)、C的结构简式是(3)、芳香烃D的一氯代物只有两种,则D的结构简式是(4)、反应③的反应类型是(5)、反应②和⑤的化学方程式分别是:
+H2O(1)、G中官能团的名称是(2)、C的结构简式是(3)、芳香烃D的一氯代物只有两种,则D的结构简式是(4)、反应③的反应类型是(5)、反应②和⑤的化学方程式分别是:反应②
反应⑤
(6)、已知: 。E也可由A和2,4-己二烯为原料制备,请写出该合成路线(无机试剂任选)。
。E也可由A和2,4-己二烯为原料制备,请写出该合成路线(无机试剂任选)。