广东省惠州市2016-2017学年高一上学期化学期末考试试卷
试卷更新日期:2018-01-06 类型:期末考试
一、单选题
-
1. 下列元素属于卤族元素的是( )A、He B、P C、Li D、F2. 下列物质中,属于混合物的是( )
A、氖气 B、盐酸 C、液氨 D、碳酸钠3. 下列物质属于电解质的是( )A、SO3 B、Na2SO4 C、Cl2 D、酒精(C2H5OH)4. 漂白粉的成分主要是( )A、氯化钙 B、次氯酸钙 C、氯化钙与次氯酸钙 D、次氯酸5. 下列现象是由于物理变化引起的是( )A、漂白粉使某些染料褪色 B、氯水使有色布条褪色 C、二氧化硫使品红溶液褪色 D、活性炭使红墨水褪色6. 不能用组成元素的单质直接反应得到的物质是( )
A、NO B、FeCl2 C、SO2 D、NH37. 实现下列变化 ,需要加入还原剂的是( )
A、N2→NO B、HNO3→NO C、BaCl2→BaSO4 D、Fe2+→Fe3+8. 许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )A、氯、溴、碘 B、钠、镁、铝 C、烧碱、氢气 D、食盐、淡水9. 酸雨是指( )A、酸性的雨 B、pH=5.6的雨 C、pH<5.6的雨 D、pH=5的雨10. 下列物质暴露在空气中不容易变质的是( )
A、Na2O B、Na2O2 C、NaOH D、Na2SO411. 矿泉水瓶上的部分说明文字,列出了饮用天然水理化指标,这里的钙、钾、钠是指( )A、原子 B、分子 C、单质 D、元素12. 等质量的下列气体中,所含的分子数最多的是( C-12 H-1 O-16 N-14) ( )
A、O2 B、CH4 C、CO D、NO13. 近年来,加“碘”食盐中较少使用碘化钾,因其口感苦涩且在贮藏和运输中易变化,目前代之加入是( )A、I2 B、KIO C、NaIO D、KIO314. A、B、C三种金属,A中混有C时A先腐蚀,A与B组成原电池,A为电池正极,则A、B、C三种金属的活动性顺序为( )
A、A>B>C B、A>C>B C、B>A>C D、B>C>A15. 苹果汁中含有Fe2+ , 现榨的苹果汁在空气中会由浅绿色变为棕黄色.若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )A、氧化性 B、还原性 C、碱性 D、酸性16. 分别加入适量下列物质,能使淀粉-KI溶液变蓝的是( )
A、NaCl B、Fe粉 C、盐酸 D、新制氯水17. 在下列反应中氧化剂和还原剂为同一物质的是( )
A、Cl2+H2=2HCl B、CuO +CO Cu +CO2 C、3S +6NaOH 2Na2S + Na2SO3 + 3H2O D、2Na+2H2O=2NaOH+H2↑18. 下列反应中,能放出气体,又属于非氧化还原反应的是( )
A、浓盐酸与二氧化锰共热 B、浓硫酸与铜共热 C、过氧化钠与水反应 D、石灰石与稀盐酸反应19. 在一定温度和压强下,2体积AB2气体和1体积B2气体恰好化合成2体积的C气体,则C的化学式可能为( )
A、AB2 B、AB3 C、A3B D、A2B320. 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与浓度和反应温度有关,下列各组物质由于浓度不同而发生不同反应的是:( )
A、Cu与HNO3 B、Cu与FeCl3 C、Zn与HCl D、FeCl3与NaOH21. 某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )
A、Cu和稀硝酸反应 B、Zn和稀盐酸反应 C、Fe和稀硫酸反应 D、Al和稀盐酸反应22. 氯化钡有剧毒,致死量为0.3g,万一不慎误服,应大量吞服鸡蛋清及适量解毒剂,此解毒剂是( )
A、AgNO3 B、CuSO4 C、MgSO4 D、Na2CO323. 飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉 降,它与空气中的SO2和O2接触时,SO2会部分转化为SO3 , 使空气的酸度增加,飘尘所起的作用可能是( )A、氧化剂 B、还原剂 C、催化剂 D、载体24. 用自来水养金鱼,在将水注入鱼缸之前,常需把水在阳光下晒一段时间,主要目的是( )
A、增加水中氧气的含量 B、起杀菌作用 C、使水中的次氯酸分解 D、使水的温度升高25. 我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO3+S+3C=K2S+N2↑+3CO2↑,该反应中被还原的元素是( )
A、C B、N C、N和S D、N和C26. 下列可用于检验实验室久置的FeSO4溶液是否含有Fe3+的试剂是( )
A、石蕊试液 B、酚酞试液 C、新制氯水 D、KSCN溶液27. 某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金),为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误: ( )A、硫酸铜溶液 B、盐酸 C、稀硝酸 D、硝酸银溶液28. 下列说法不正确的是( )A、严格执行机动车尾气排放标准有利于防止大气污染 B、使用二氧化硫增白的食品对人体健康产生损害 C、使用氯气对自来水消毒时生成的有机氯化物可能对人体有害 D、食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼29. 含有CO、N2、H2、CO2和少量水蒸气的混合气体,依次通过足量的灼热氧化铜、浓氢氧化钠溶液、浓硫酸后,剩余的气体是( )A、N2 B、N2和H2 C、N2和CO2 D、H2和CO30. 下列气体不能用排水法收集而要用向上排空气法收集的是( )A、NO2 B、O2 C、NH3 D、NO31. 实验室配制氯化亚铁溶液时,为了防止其氧化,常加入的物质是( )
A、Zn B、Fe C、Al D、HCl32. 在无色透明的碱性溶液中,能大量共存的离子组是( )
A、Na+、K+、CO32-、NO3- B、Cu2+、Al3+、SO42-、NO3- C、K+、Fe2+、NH4+、NO3- D、NH4+、Na+、NO3-、Cl-33. 某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A、一定有SO42- B、可能有SO42- 或Ag+ C、一定无Ag+ D、还可能有CO32-34. 关于铁及其化合物的叙述正确的是( )
A、铁是一种较活泼的金属 B、Fe2O3在常温下可以导电 C、Fe2O3溶于水生成Fe(OH)3 D、在常温下铁丝容易与水反应放出H235. 下列实验操作或事故处理正确的是( )A、金属钠着火,立即用水扑灭 B、稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中 C、实验结束后,用嘴吹灭酒精灯 D、皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗36. 在1L0.1mol.L-1的K2SO4溶液中( )A、K+的物质的量为0.1 mol B、SO42-的物质的量为0.2mol C、K+的物质的量浓度为0. 1mol.L-1 D、SO42-的物质的量浓度为0. 1mol.L-137. 下列反应的离子方程式中,书写不正确的是( )
A、钠跟水反应:2Na + 2H2O = 2Na+ + 2OH- + H2↑ B、铁粉跟稀硫酸反应:Fe + 2H+ = Fe2++ H2↑ C、氢氧化钡溶液跟稀硫酸反应:Ba2+ + SO42- = BaSO4↓ D、碳酸钙跟盐酸反应:CaCO3 + 2H+ = Ca2+ +H2O + CO2↑38. 某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害.若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是( )A、Fe2+、Cu2+ B、Cu2+、H+ C、Zn2+、Fe2+ D、Zn2+、H+39. 下列操作不能用于检验NH3的是( )
A、气体使湿润的酚酞试纸变红 B、气体能使湿润的红色石蕊试纸变蓝 C、气体与蘸有浓H2SO4的玻璃棒靠近 D、气体与蘸有浓盐酸的玻璃棒靠近40. 用20g氢氧化钠固体配成1 mol·L﹣1的NaOH溶液,所得溶液的体积是( )
A、1000 mL B、500 mL C、100 mL D、50 mL41. 用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是( )
A、称量时,将固体NaOH直接放在天平右盘上 B、将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 C、定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 D、将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中42. 绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列用氨气氮肥的制备反应中,原子利用率最高的是( )A、NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl B、2NH3+CO2=2H2O+CO(NH2)2 C、8NH3+3Cl2=N2+6NH4Cl D、NH3+HCl=NH4Cl43. 下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是( )
A、NaHCO3 B、Na2CO3 C、FeSO4 D、NaCl44. 氯气是一种重要的工业原料。工业上利用反应3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是( )
A、若管道漏气遇氨就会产生白烟 B、该反应利用了Cl2的强氧化性 C、生成1 mol N2有3 mol 电子转移 D、该反应不属于复分解反应45. 将氯化钠、氯化铵、氯化铁、氯化镁四种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是:( )
A、NaOH B、HCl C、KSCN D、BaCl246. 用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu = 2Fe2++ Cu2+。下列有关说法错误的是( )
A、Cu是还原剂,被腐蚀 B、Fe3+是氧化剂 C、该反应是置换反应 D、该反应属于离子反应47. 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为( )
A、加入过量Na2CO3溶液,过滤,除去沉淀,溶液中补加适量硝酸 B、加入过量K2SO4溶液,过滤,除去沉淀,溶液中补加适量硝酸 C、加入过量Na2SO4溶液,过滤,除去沉淀,溶液中补加适量硝酸 D、加入过量K2CO3溶液,过滤,除去沉淀,溶液中补加适量硝酸48. 有关Na2CO3和NaHCO3的叙述中正确的是( )
A、相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 B、Na2CO3比NaHCO3热稳定性强 C、Na2CO3不能与澄清石灰水反应 D、Na2CO3和NaHCO3均可与NaOH溶液反应49. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( S-32 O-16 ) ( )A、标准状况下,22.4L氦气含有2NA个氦原子 B、在常温常压下,11.2L Cl2含有的分子数为0.5NA C、常温常压下,64g SO2中含有的氧原子数为2NA D、标准状况下,11.2LH2O含有的分子数为0.5NA50. 现有三种常见治疗胃病药品的标签:( )
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是( 相对原子质量 Ca -40 C-12 O-16 H-1 Mg-24 )A、①=②=③ B、①>②>③ C、③>②>① D、②>③>①二、实验题
-
51. 某小组同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题:
(一)制取氨气(1)、写出实验制取氨气的化学方程式;
(2)、有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?(填“能”或“否”),理由是。
(3)、(二)该小组中某同学设计了如下实验装置(夹持及尾气入理装置未画出),探究氨气的还原性: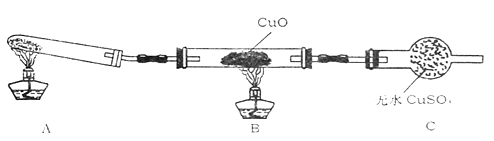
该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是。
(4)、利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式。
52. Fe3O4是重要的化学试剂,其化学式还可以表示为FeO·Fe2O3 , 铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。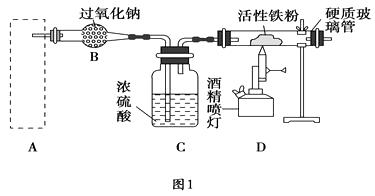
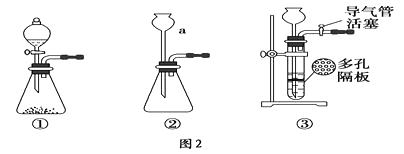 (1)、图2中仪器a的名称是。(2)、根据题目要求,在图2中最好选择(填序号)作为A装置。(3)、对图2中装置②进行气密性检查的方法是。(4)、在B装置中发生的主要反应的化学方程式是。(5)、反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有(填名称)。(6)、写出Fe3O4溶于足量稀硫酸的离子方程式 , 要检验所得溶液中的Fe3+ , 常用试剂是(填名称)。
(1)、图2中仪器a的名称是。(2)、根据题目要求,在图2中最好选择(填序号)作为A装置。(3)、对图2中装置②进行气密性检查的方法是。(4)、在B装置中发生的主要反应的化学方程式是。(5)、反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有(填名称)。(6)、写出Fe3O4溶于足量稀硫酸的离子方程式 , 要检验所得溶液中的Fe3+ , 常用试剂是(填名称)。
53. 硫酸铜的制备实验是化学实验教学中一个必做实验,某学习小组设计了如下两个实验方案:(1)、实验一:因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有。
(2)、该反应的化学方程式为。(3)、实验二:以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
Fe2(SO4)3的作用是。
(4)、得到的混合液可以用下列四种物质中的 调节溶液的pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:A、NaOH B、CuO C、 CuCO3 D、Fe(5)、请根据以上内容,对这两个实验方案进行评价,填下表:实 验 (一)
实 验 (二)
主要优点
操作简便
⑴原料充分转化为产品
⑵没有有害气体排放
主要缺点
54. 某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶C中溶液蓝色刚好消失时,立即关闭活塞A。 (1)、C中导管末端连接一个多孔球泡D,其作用是 , 可以提高实验的准确度。(2)、C中发生反应为SO2 + I2 +2H2O = H2SO4+ 2HI , I2 是(氧化剂、还原剂)。(3)、某同学根据反应:SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl,设计了一个实验,比较SO2与Fe2+ 还原性的强弱:取少量C中溶液于试管中,滴加2mL氯化铁溶液,摇匀,滴入几滴KSCN溶液,溶液不变红色 ,(试剂任选,请完善步骤、现象和结论)。(4)、① 当流量计B中刚好通过2L尾气时,C中溶液蓝色刚好消失,立即关闭活塞A,容器C中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为g/L。 (相对原子质量: Ba-137 S-32 O-16)
(1)、C中导管末端连接一个多孔球泡D,其作用是 , 可以提高实验的准确度。(2)、C中发生反应为SO2 + I2 +2H2O = H2SO4+ 2HI , I2 是(氧化剂、还原剂)。(3)、某同学根据反应:SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl,设计了一个实验,比较SO2与Fe2+ 还原性的强弱:取少量C中溶液于试管中,滴加2mL氯化铁溶液,摇匀,滴入几滴KSCN溶液,溶液不变红色 ,(试剂任选,请完善步骤、现象和结论)。(4)、① 当流量计B中刚好通过2L尾气时,C中溶液蓝色刚好消失,立即关闭活塞A,容器C中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为g/L。 (相对原子质量: Ba-137 S-32 O-16)② 若洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量(填“偏高”、“偏低”或“无影响”).
55. 氧化铜矿石含有CuO和难溶于水的Cu2(OH) 2CO3 , 还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某厂生产硫酸铜和硫酸亚铁流程如下: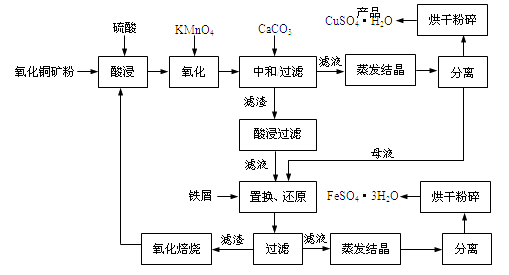 (1)、氧化铜矿石粉碎的目的是 , KMnO4的作用是将Fe2+氧化成Fe3+。(2)、写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。(3)、“中和/过滤”中加入CaCO3的目的是 , 使Fe3+ 水解成沉淀而除去。
(1)、氧化铜矿石粉碎的目的是 , KMnO4的作用是将Fe2+氧化成Fe3+。(2)、写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。(3)、“中和/过滤”中加入CaCO3的目的是 , 使Fe3+ 水解成沉淀而除去。
(4)、流程中多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、。(5)、加入铁屑的作用是使母液中Fe3+转化为Fe2+、。(6)、下表为硫酸铜晶体“烘干粉碎”的试验结果。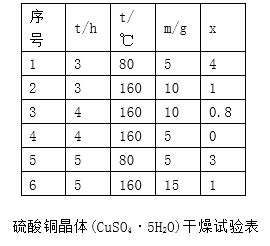
表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品的适宜工艺条件为(指出条件的温度和时间)。