备考2018年高考化学一轮基础复习:专题23 弱电解质的电离平衡
试卷更新日期:2018-01-04 类型:一轮复习
一、单选题
-
1. 下列化学用语正确的是( )A、氟化氢的电子式:
 B、氯原子的结构示意图:
B、氯原子的结构示意图:  C、氯化钠的电离方程式:NaCl=Na++Cl﹣
D、乙醇的结构式:C2H6O
2. 用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )A、 B、 C、c(H+)和c(OH﹣)的乘积 D、OH﹣的物质的量3. 下列各选项所描述的两个量中,前者一定大于后者的是( )A、CH3COONa溶液中CH3COO﹣和Na+的数目 B、纯水在80℃和25℃时的pH C、相同温度下,100mL0.01mol•L﹣1醋酸与10mL0.1mol•L﹣1醋酸中H+的物质的量 D、相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH﹣)4. 下列图示与对应的叙述相符的是( )A、
C、氯化钠的电离方程式:NaCl=Na++Cl﹣
D、乙醇的结构式:C2H6O
2. 用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )A、 B、 C、c(H+)和c(OH﹣)的乘积 D、OH﹣的物质的量3. 下列各选项所描述的两个量中,前者一定大于后者的是( )A、CH3COONa溶液中CH3COO﹣和Na+的数目 B、纯水在80℃和25℃时的pH C、相同温度下,100mL0.01mol•L﹣1醋酸与10mL0.1mol•L﹣1醋酸中H+的物质的量 D、相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH﹣)4. 下列图示与对应的叙述相符的是( )A、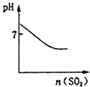 可表示将SO2气体通入溴水时pH的变化
B、
可表示将SO2气体通入溴水时pH的变化
B、 表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C、
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C、 表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D、
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D、 表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
5. 常温下,HNO2的电离平衡常数为K=4.6×10﹣4(已知 =2.14),向20mL0.01mol•L﹣1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
5. 常温下,HNO2的电离平衡常数为K=4.6×10﹣4(已知 =2.14),向20mL0.01mol•L﹣1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )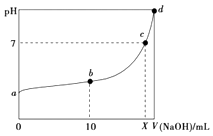 A、HNO2的电离方程式为HNO2=NO2﹣+H+ B、a点H2O电离出的c(H+)=2.14×10﹣3mol•L﹣1 C、b点溶液中离子浓度大小关系为c(NO2﹣)>c(Na+)>c(H+)>c(OH﹣) D、X值等于206. 下列说法正确的是( )A、在100℃、101kPa条件下,液态水的气化热为40.69kJ•mol﹣1 , 则H2O(g)⇌H2O(l)的△H=40.69kJ•mol﹣1 B、常温下,在0.10mol•L﹣1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 C、已知:
A、HNO2的电离方程式为HNO2=NO2﹣+H+ B、a点H2O电离出的c(H+)=2.14×10﹣3mol•L﹣1 C、b点溶液中离子浓度大小关系为c(NO2﹣)>c(Na+)>c(H+)>c(OH﹣) D、X值等于206. 下列说法正确的是( )A、在100℃、101kPa条件下,液态水的气化热为40.69kJ•mol﹣1 , 则H2O(g)⇌H2O(l)的△H=40.69kJ•mol﹣1 B、常温下,在0.10mol•L﹣1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 C、已知:
则反应共价键 C﹣C C=C C﹣H H﹣H 键能/kJ•mol﹣1 348 610 413 436 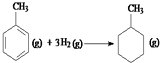 的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJ•mol﹣1=﹣384kJ•mol﹣1
D、已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)•c(CO32﹣)=6.82×10﹣6
7. 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJ•mol﹣1=﹣384kJ•mol﹣1
D、已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)•c(CO32﹣)=6.82×10﹣6
7. 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;Ka•Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
A、①④ B、①②④ C、①②④⑤ D、①②③④二、填空题
-
8. 根据问题填空:(1)、现有下列物质 A.氯化钠 B.醋酸 C.硫酸钡 D.醋酸钠,请用以上物质回答下列问题.
①属于弱电解质的是 , 写出其水溶液的电离方程式:;
②D物质的水溶液显(填酸性、碱性或中性),用离子方程式表示其原因 , 其水溶液中离子浓度大小关系为 .
(2)、某温度水的离子积KW=1×10﹣12 , 则该温度(填“>”、“<”或“=”)25℃.9. 已知醋酸和盐酸是日常生活中极为常见的酸.常温常压,在 pH=5的稀醋酸溶液中,c(CH3COO‾)=;下列方法中,可以使0.10mol/LCH3COOH的电离程度增大的是 .
a.加入少量0.10mol/L的稀盐酸b.加热CH3COOH溶液c.加入少量冰醋酸
d.加水稀释至0.010mol/L e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液.
10. 一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO﹣),用含a和b.的代数式表示该混合溶液中醋酸的电离常数为: .三、实验探究题
-
11. 为研究CH3COOH、HA和MOH的酸碱性的相对强弱,某兴趣小组设计了以下实验:室温下,将pH=2的两种酸溶液CH3COOH、HA和pH=12的碱MOH溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图1所示,根据所给数据,请回答下列问题:
 (1)、HA为酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的
(1)、HA为酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的c(H+)醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).
若b+c=14,则MOH为碱(填“强”或“弱”).
(2)、常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是 .A、c(H+) B、c(H+)/c(CH3COOH) C、c(H+)•c(OH﹣) D、c(OH﹣)/(H+)(3)、常温下,用0.10mol•L﹣1 NaOH溶液分别滴定20mL 0.10mol•L﹣1 HCl溶液和20mL 0.10 mol•L﹣1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是(填“图2”或“图3”);曲线上E点pH>8的原因是(用离子方程式表示) .(4)、25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为四、综合题
-
12. 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号
HA物质的量浓度
(mol•L﹣1)
NaOH物质的量浓度
(mol•L﹣1)
混合溶液的pH
甲
0.2
0.2
pH=a
乙
c
0.2
pH=7
丙
0.2
0.1
pH>7
丁
0.1
0.1
pH=9
(1)、不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .(2)、不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .(3)、丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .(4)、丁组实验所得混合溶液中由水电离出的c(OH﹣)=mol•L﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=mol•L﹣1 c(OH﹣)﹣c(HA)=mol•L﹣1 .13. 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.(1)、有关上述常数的说法正确的是 .a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)、25℃时将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=(3)、已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为(4)、25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2mol•L﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1mol•L﹣1的NaHSO3溶液中c(H2SO3)= .(5)、已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)
-