广东省汕头市龙湖区2015-2016学年九年级上学期化学期末考试试卷
试卷更新日期:2018-01-04 类型:期末考试
一、单选题
-
1. 下列为一些物质的自我介绍,其中介绍自己化学性质的是( )A、我是紫红色固体 B、我在自然界中硬度最大 C、我在常温下是气体 D、我会生锈2. 下列措施中不利于PM2.5治理的是( )A、研发新能源汽车 B、发展燃煤发电 C、禁止焚烧秸秆 D、加强建筑工地扬尘控制3. 下列实验操作符合规范的是( )A、
 B、
B、 C、
C、 D、
D、 4. 小明阅读《科学大众》杂志后,对抽烟的爸爸说:“吸烟有害健康,我和妈妈都在被动吸烟.”小明这样说的科学依据是( )A、分子很小 B、分子在不断滚动 C、分子之间有间隙 D、分子之间有作用力5. 某品牌紫菜的营养成分表显示,每100g紫菜含钠291mg,这里所说的钠是指( )A、元素 B、单质 C、分子 D、原子6. 化学实验离不开现象的观察和描述,下列有关实验现象的描述中正确的是( )A、白磷在空气中燃烧产生大量白雾 B、将点燃的木炭放入氧气中剧烈燃烧,发出白光 C、硫在氧气中燃烧发出淡蓝色火焰 D、铁丝在氧气中燃烧火星四射,生成四氧化三铁7. 对下列知识的归纳,都正确的一组是( )A、生活常识取暖防中毒﹣﹣煤炉上放一盆水炒菜时油锅着火﹣﹣用锅盖盖灭 B、节约意识用剩药品﹣﹣应放回原瓶取用药品﹣﹣应取少量 C、安全常识厨房煤气泄漏﹣﹣打开排气扇家用电器着火﹣﹣用水浇灭 D、环保意识使用含磷洗衣粉﹣﹣含污染水源减少白色污染﹣﹣使用可降解塑料8. 根据如图原子结构示意图,得出结论正确的是( )
4. 小明阅读《科学大众》杂志后,对抽烟的爸爸说:“吸烟有害健康,我和妈妈都在被动吸烟.”小明这样说的科学依据是( )A、分子很小 B、分子在不断滚动 C、分子之间有间隙 D、分子之间有作用力5. 某品牌紫菜的营养成分表显示,每100g紫菜含钠291mg,这里所说的钠是指( )A、元素 B、单质 C、分子 D、原子6. 化学实验离不开现象的观察和描述,下列有关实验现象的描述中正确的是( )A、白磷在空气中燃烧产生大量白雾 B、将点燃的木炭放入氧气中剧烈燃烧,发出白光 C、硫在氧气中燃烧发出淡蓝色火焰 D、铁丝在氧气中燃烧火星四射,生成四氧化三铁7. 对下列知识的归纳,都正确的一组是( )A、生活常识取暖防中毒﹣﹣煤炉上放一盆水炒菜时油锅着火﹣﹣用锅盖盖灭 B、节约意识用剩药品﹣﹣应放回原瓶取用药品﹣﹣应取少量 C、安全常识厨房煤气泄漏﹣﹣打开排气扇家用电器着火﹣﹣用水浇灭 D、环保意识使用含磷洗衣粉﹣﹣含污染水源减少白色污染﹣﹣使用可降解塑料8. 根据如图原子结构示意图,得出结论正确的是( ) A、①②③④分别表示一种元素 B、②和④是两种金属元素 C、②带正电荷,是阳离子 D、①和③化学性质相似9. 如图为元素周期表第4周期的一部分.据此判断下列说法中错误的是( )
A、①②③④分别表示一种元素 B、②和④是两种金属元素 C、②带正电荷,是阳离子 D、①和③化学性质相似9. 如图为元素周期表第4周期的一部分.据此判断下列说法中错误的是( ) A、镍元素的符号为Ni B、钴元素的相对原子质量是58.93g C、从左到右各元素的原子序数依次增大 D、各元素都属于金属元素10. 科学家用计算机模拟后确认,60个N原子可结合成N60分子.下列关于N60的叙述中正确的是( )A、N60是一种新型的化合物 B、一个N60分子中含有30个N2分子 C、N60的相对分子质量为740 D、N60和N2混合后形成的是混合物11. 用“
A、镍元素的符号为Ni B、钴元素的相对原子质量是58.93g C、从左到右各元素的原子序数依次增大 D、各元素都属于金属元素10. 科学家用计算机模拟后确认,60个N原子可结合成N60分子.下列关于N60的叙述中正确的是( )A、N60是一种新型的化合物 B、一个N60分子中含有30个N2分子 C、N60的相对分子质量为740 D、N60和N2混合后形成的是混合物11. 用“ ”和“
”和“  ”分别代表两种不同单质A2和B2的分子,A2和B2在一定条件下能发生化学反应生成新物质X,微观过程如图所示.下列说法正确的是( )
”分别代表两种不同单质A2和B2的分子,A2和B2在一定条件下能发生化学反应生成新物质X,微观过程如图所示.下列说法正确的是( ) A、在反应过程中A2和B2分子保持不变 B、该反应为置换反应 C、参加反应的A2与B2分子数之比为3:1 D、物质X含4种元素12. 下列操作能达到实验目的是( )
A、在反应过程中A2和B2分子保持不变 B、该反应为置换反应 C、参加反应的A2与B2分子数之比为3:1 D、物质X含4种元素12. 下列操作能达到实验目的是( )选项
实验目的
实验操作
A
除去CO2中的CO
点燃
B
鉴别氧化铜和二氧化锰
观察颜色
C
除去铜粉中的少量铁粉
加入足量稀硫酸,过滤
D
除去FeCl2溶液中的CuCl2
加入足量的锌粉,过滤
A、A B、B C、C D、D13. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示.下列说法正确的是( ) A、该反应中乙、丙的质量比为3:17 B、该反应中甲、丙的质量比为7:10 C、该反应的基本类型为分解反应 D、丁一定是该反应的催化剂14. 下列图象能正确反映对应变化关系的是( )A、
A、该反应中乙、丙的质量比为3:17 B、该反应中甲、丙的质量比为7:10 C、该反应的基本类型为分解反应 D、丁一定是该反应的催化剂14. 下列图象能正确反映对应变化关系的是( )A、 足量红磷在密闭容器中燃烧
B、
足量红磷在密闭容器中燃烧
B、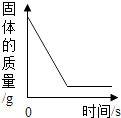 将铜片加入一定量的硝酸银溶液中
C、
将铜片加入一定量的硝酸银溶液中
C、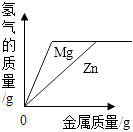 向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D、
向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D、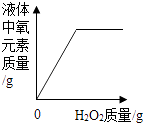 向盛有一定量MnO2的烧杯中加入H2O2溶液
向盛有一定量MnO2的烧杯中加入H2O2溶液
二、填空题
-
15. 请用化学符号表示下列物质或微粒:
①2个氮原子 . ②硫酸根离子 . ③2个氧分子 .
16. 通过化学学习,同学们对组成万物的基本物质有了进一步了解.(1)、现有H、C、S、O四种元素,请选用其中的元素写出下列物质的化学式:①造成酸雨的气体;
②极易与血红蛋白结合的有毒气体;
③能用于练钢、气焊和医疗急救的是;
(2)、如图是某陨石样品中各种元素含量的比例图:
①该陨石中含种非金属元素.
②此陨石样品中不可能含有的化合物是 .
A.CaCO3 B.K2SO4 C.Al2O3 D.SiO2 .
17. 水是我们人类宝贵的自然资源.请你参与下列有关问题的讨论: (1)、如图是市场上出售的一种活性炭净水器的示意图.这种净水器可以除去水中的难溶性物质,同时利用活性炭的作用除去臭味和一些可溶的杂质;(2)、在实验室中要除去天然水中的固体杂质,可以采用的方法;(3)、长期饮用硬水对人体健康不利,要降低水的硬度,在家庭里通常采用的方法.18. 研究和控制化学反应条件对生产生活具有重要意义.(1)、用过氧化氢制氧气需加入MnO2 , MnO2的作用是 .(2)、用如图所示装置进行燃烧实验的探究.Y型试管的管口系紧小气球.
(1)、如图是市场上出售的一种活性炭净水器的示意图.这种净水器可以除去水中的难溶性物质,同时利用活性炭的作用除去臭味和一些可溶的杂质;(2)、在实验室中要除去天然水中的固体杂质,可以采用的方法;(3)、长期饮用硬水对人体健康不利,要降低水的硬度,在家庭里通常采用的方法.18. 研究和控制化学反应条件对生产生活具有重要意义.(1)、用过氧化氢制氧气需加入MnO2 , MnO2的作用是 .(2)、用如图所示装置进行燃烧实验的探究.Y型试管的管口系紧小气球.
①能燃烧的是(填“a”、“b”或“c”处),该处燃着的磷会很快熄灭,原因可能是(填序号).
A.温度降低 B.氧气耗尽 C.试管内产生CO2气体
②管口的小气球可以防止(填化学式)进入空气污染环境.
③比较试验a和c,可知白磷燃烧需要;比较实验a和b,可知物质燃烧需要 .
19. 钢铁在生产生活中具有广泛用途.(1)、第四套人民币硬币一元为钢芯镀镍(Ni),伍角为钢芯镀钢,一角为铝合金或不锈钢①铸造硬币主要用到的都是材料.
②选择铸造硬币的材料不需要考虑的因素是(填序号)
A.金属的硬度; B.金属的导电性;
C.金属的耐腐蚀性; D.金属价格与硬币面值的吻合度
③铸造硬币涉及到Fe、Cu、Al、Ni(镍)四种金属,已知Ni能够发生如下反应:
Ni+H2SO4=H2↑+NiSO4 Fe+NiCl2=Ni+FeCl2
四种金属的活动性由强到弱的顺序是(用元素符号表示).
(2)、工业上用一氧化碳冶炼铁的化学方程式是 .(3)、室温下,铁与水蒸气能反应生成一种常见的铁的氧化物和一种气体.涉及如图实验探究铁粉与水蒸气反应后的产物.
①试管尾部放一团湿棉花的目的是 .
②如图所示,有肥皂泡飘到空中,用燃着的木条靠近肥皂泡,有爆鸣声.说明生成的气体是 .
③充分反应后,试管中剩余固体成分可能是Fe2O3或Fe3O4中的一种,利用物理性质,鉴别的方法是 .
20. 表示某些物质间的转化关系(反应条件均略去).其中A为天然气的主要成分,C为相对分子质量最小的氧化物,F为红色粉末,G为最常见的金属.B、D、E、X均为无色气体.请回答: (1)、X是(填化学式)(2)、B物质固态时的名称是 , 该固态物质在实际生活中的一种用途是 .(3)、写出下列反应的化学方程式:
(1)、X是(填化学式)(2)、B物质固态时的名称是 , 该固态物质在实际生活中的一种用途是 .(3)、写出下列反应的化学方程式:①A+E→B+C
②C→D+E
③G与盐酸的反应方程式 .
21.(1)、如图是科学家正在研究的二氧化碳循环利用技术:
①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物.写出反应的化学方程式 .
②从图中分析得出的下列结论中,正确的是(填序号)
A.该技术符合低碳经济的理念
B.水生成氢气的过程中所用的催化剂一定是二氧化锰
C.该技术有助于缓解全球面临的能源危机
(2)、该流程中可循环使用的物质是和水.(3)、尿素[CO(NH2)2]对提高粮食产量具有重要的作用,人们控制条件可以使CO2和物质M发生反应:CO2+2M=CO(NH2)2+H2O,物质M的化学式为 .22. 实验室常用下列装置制取气体,请你根据所学知识回答下列问题. (1)、写出编号所指仪器的名称:①;(2)、以上装置图中共有两处明显的错误,请你找出错误的地方并把改正的结果填在下列横线上:
(1)、写出编号所指仪器的名称:①;(2)、以上装置图中共有两处明显的错误,请你找出错误的地方并把改正的结果填在下列横线上:①;② .
上述装置改进后,请继续回答下列问题.
(3)、用高锰酸钾制取比较纯净的氧气,应选择上述装置中的A和(填字母),写出该反应的化学方程式: .(4)、实验室选用B和E装置组合,除能制取O2外,还可以制取的一种气体是 .(5)、比较B、C装置的不同,指出B装置的优点是 .(6)、有一名同学欲用G装置收集H2 , 则H2应从导管口通入.(填写a或b)23. 我国女科学家屠呦呦因提炼出用以治疗疟疾的青蒿素(化学式:C15H22O5)而获得2015年诺贝尔生理学或医学奖,把植物青蒿推到世界面前,请回答:(1)、青蒿素分子中C,H,O原子个数比为 .(2)、青蒿素中C,H,O元素的质量比为 .(3)、141g青蒿素中氧元素的质量是g.三、实验探究题
-
24. 某学习小组学习完碳的还原性后,对碳还原氧化铜后生成的气体是否一定是二氧化碳产生了怀疑.
【查阅资料】
①在本实验中为了保证实验成功,通过碳的质量是要过量的.
②被还原出来的铜在温度较高时很容易与空气中的氧气反应生成氧化铜.
③氮气不与碳、氧化铜产生反应,可用来隔绝空气(氧气).
(1)、【提出问题】木炭还原氧化铜产生的是什么气体?根据质量守恒定律可知,产生的气体有三种情况
①全部是CO2 ②全部是CO ③;
若猜想②成立,木炭还原氧化铜反应的化学方程式为: .
(2)、【设计方案】由于二氧化碳可以被石灰水吸收面一氧化碳不能被石灰水吸收,从二氧化碳质量关系可以确定气体的组成.【实验】

操作步骤及实验现象
简答
①称取0.8g氧化铜与0.2g碳粉均匀混合,放入重25g的玻璃管中,同时称得广口瓶和石灰水的总质量为500g,按图中装置连接
/
②加热前,先通一段时间纯净、干燥的氮气
其目的是
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊
澄清石灰水变浑浊的方程式为
④完全反应后,冷却至室温,称得玻璃管和固体总质量为25.5g
⑤称得广口瓶和石灰水的总质量为500.4g
(3)、【结论】根据数据处理结果,得出猜想成立.四、简答题
-
25. 某同学为测定实验室中某氯酸钾样品的纯度,取2.5g该样品与0.5g二氧化锰混合,加热该混合物t1时间后(杂质不参加反应),冷却,称量剩余固体质量,重复以下操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表
加热时间
t1
t2
t3
t4
剩余固体质量(g)
2.68
2.52
2.04
2.04
(1)、加热至t3时间时,氯酸钾是否已经完全反应?(填“是”或“否”).(2)、完全反应后产生氧气的质量是g.(3)、计算t2时刻,样品中有多少氯酸钾发生了分解?
-