备考2018年高考化学一轮基础复习:专题22 化学平衡的移动
试卷更新日期:2017-12-26 类型:一轮复习
一、单选题
-
1. 下列化学工业所采取的措施中,能用勒夏特列原理解释的是( )A、合成氨工业:温度控制在500℃左右 B、接触法制硫酸:SO2在常压下催化氧化 C、侯氏制碱法:往母液中继续加入食盐和氨气 D、石油化工:将分馏得到的重油在高温下裂化2. 在一定温度下的恒容密闭容器中,下列叙述不是可逆反应A(g)+3B(g)⇌2C(g)达到平衡状态标志的是
( )
①生成C的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的质量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2.
A、②⑧ B、①⑥ C、②④ D、③⑧3. 下列对化学平衡移动的分析中,不正确的是( )①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A、①④ B、①②③ C、②③④ D、①②③④4. 某反应4A(g)⇌mB(g)+2C(g)速率﹣时间图象如图,其中t2、t3、t4、t5是平衡后只改变一个条件.下列叙述中一定正确的是( )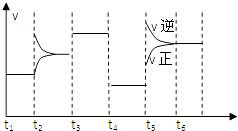 A、△H>0 B、t2时刻改变的条件是增大压强 C、t3时刻改变的条件是使用催化剂 D、t4改变条件时平衡常数不变5. 在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H>0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A、△H>0 B、t2时刻改变的条件是增大压强 C、t3时刻改变的条件是使用催化剂 D、t4改变条件时平衡常数不变5. 在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H>0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )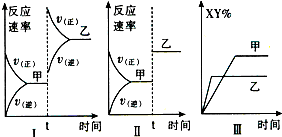 A、图I是升高温度的变化情况 B、图Ⅱ是扩大容器体积的变化情况 C、图Ⅲ是增大压强的变化情况 D、图Ⅲ是升高温度的变化情况6. 合成氨反应为N2+3H2⇌2NH3 , 今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )A、恒温恒容:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3 B、恒温恒压:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3 C、恒温恒容:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH3 D、恒温恒压:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH37. 已知一定温度下,2X(g)+Y(g)⇌mZ(g)△H=﹣a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2mol X和1mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1mol X和0.5mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )A、m=4 B、a=b C、a< D、m<38. 在一个1L的容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)⇌3C(g)+D(s).平衡时,C的浓度为1.2mol/L.维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,下列组合能达到的是( )A、6molC+xmolD(x>0.6) B、1molA+0.5molB+1.5molC+xmolD(x>0.1) C、3molA+1.5molB+x molD(x≥0) D、1molA+0.5molB+3molC+xmolD(x>0)
A、图I是升高温度的变化情况 B、图Ⅱ是扩大容器体积的变化情况 C、图Ⅲ是增大压强的变化情况 D、图Ⅲ是升高温度的变化情况6. 合成氨反应为N2+3H2⇌2NH3 , 今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )A、恒温恒容:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3 B、恒温恒压:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3 C、恒温恒容:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH3 D、恒温恒压:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH37. 已知一定温度下,2X(g)+Y(g)⇌mZ(g)△H=﹣a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2mol X和1mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1mol X和0.5mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )A、m=4 B、a=b C、a< D、m<38. 在一个1L的容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)⇌3C(g)+D(s).平衡时,C的浓度为1.2mol/L.维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,下列组合能达到的是( )A、6molC+xmolD(x>0.6) B、1molA+0.5molB+1.5molC+xmolD(x>0.1) C、3molA+1.5molB+x molD(x≥0) D、1molA+0.5molB+3molC+xmolD(x>0)二、填空题
-
9. 已知某温度下,反应2SO2+O2⇌2SO3 , 的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol•L﹣1 , C(O2)=1 mol•L﹣1 , 当反应在该温度下SO2 , 为80%时,该反应(填“是”或“否”)达到化学平衡状态,若未达到,向(填“正反应”或“逆反应”)方向进行.10.
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)⇌2C(g)+D(s),已知将2molA和1molB
充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n%。
(1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如图),则该反应的正反应是 反应。
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是
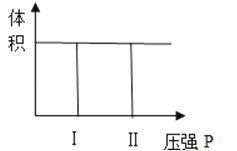
(3)若将原容器改为容积可变的容器,在一定温度和常压下,将2molA和1molB充入该容器中,建立平衡之后,B的物质的量浓度为a mol/L.
Ⅰ、现持续增大压强,当:
①当压强为原来1.5倍时,B的平衡时物质的量浓度为m mol/L,测得m<1.5a;
②当压强为原来10倍时,B的平衡时物质的量浓度为n mol/L,测得n>10a;
试解释形成第②种结果的可能原因是
Ⅱ、再将2molA和1molB充入该容器中,则反应速率(Y)与时间(X)关系图象可表示为
(4)若维持该题原条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol.则D的起始物质的量n(D) 应满足的条件是 (用含有W的代数式表示)
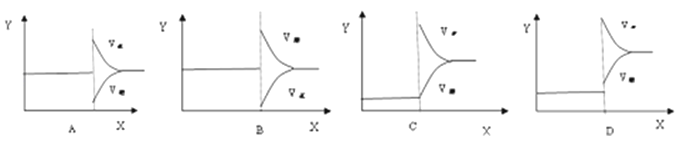
11.一定条件下反应A(g)+B(g)⇌C(g)△H<0达到平衡后,据下列图象判断:
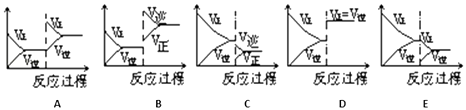
达到新的平衡对应的图象
(填写字母)
平衡移动方向
(正反应、逆反应,不移动)
(i)使用催化剂
(ii)升温
(iii)降压
(iv)增加A的量
(v)减少C的量
三、综合题
-
12. 恒温容器中加入1molN2和3molH2 , 达到平衡时NH3的体积分数为m%.若N2、H2、NH3的起始加入量分别为xmol、ymol、zmol,达到平衡时NH3的体积分数仍为m%.(1)、该容器恒容,则x、y、z应满足的关系是 .(2)、该容器恒压,则x、y、z应满足的关系是 .(3)、设前者达到平衡时生成NH3为amol,则后者达到平衡时生成NH3=mol(用a、x、z表示)13. 在某一恒容容器中,反应C(g)+D(g)=E(g)(正反应为吸热反应)达到平衡后,根据下列图象判断:
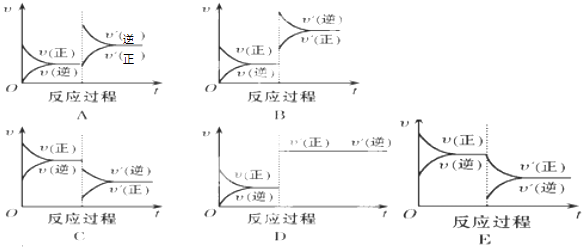 (1)、升高温度,达到新平衡的是 , 新平衡中C的体积分数(填“增大”、“减小”或“不变”).增加E的量,达到新平衡的是 .(2)、使用催化剂,达到平衡的是 , D的转化率(填“增大”、“减小”或“不变”).14. I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O⇌CO2(g)+H2(g)得到如下三组数据:
(1)、升高温度,达到新平衡的是 , 新平衡中C的体积分数(填“增大”、“减小”或“不变”).增加E的量,达到新平衡的是 .(2)、使用催化剂,达到平衡的是 , D的转化率(填“增大”、“减小”或“不变”).14. I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O⇌CO2(g)+H2(g)得到如下三组数据:实验组
温度℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
CO
H2O
CO2
1
500
8
4
3.2
4
2
700
4
2
0.8
3
3
700
4
2
0.8
1
(1)、①下列情况表明反应达到平衡状态的是 (填序号)A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
②实验2中,反应达到平衡状态时,CO的转化率为 .
③实验3和实验2相比,改变的条件是 .
(2)、①硫化钠溶液具有较强碱性,其原因是(用离子方程式表示).②欲使0.1mol的Na2S溶液中, 的值增大,可采取的措施是(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
15. T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.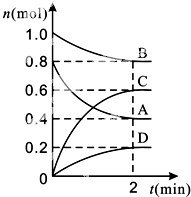
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
(1)、容器中反应的化学方程式为 .(2)、前2min,v(A)=mol•(min•L)﹣1 .(3)、能说明该反应已达到平衡状态的是 .A、混合气体的压强不变 B、混合气体的密度不变 C、消耗0.1mol的B同时生成0.1mol的D D、B的物质的量不变(4)、T℃时,该反应的平衡常数K=(保留小数点后两位).反应达到平衡后,只增加B的物质的量,则平衡移动方向为;平衡常数K(填增大.减小或不变).
(5)、反应达到平衡后,改变下列措施能使A的转化率增大的是 (填选项字母).A、只增加A的物质的量 B、移走一部分D C、升高反应体系的温度 D、把容器的体积缩小一倍(6)、T℃时,容积为1L的密闭容器中,起始时充入0.2mol A、0.4mol B、0.3mol C、0.5mol D,此时v(正) v(逆) (填“>”“<”或“=”).16. 已知:反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g);△H=Q1 , 平衡常数为K1 ,反应②Fe(s)+H2O(g)⇌FeO(s)+H2(g);△H=Q2 , 平衡常数为K2 ,
在不同温度下,K1、K2的值如下:
T(K)
K1
K2
700
1.47
2.38
900
2.15
1.67
(1)、从上表可推断,反应Q10(填“>”或“<”).(2)、现有反应③H2(g)+CO2(g)⇌CO(g)+H2O(g);△H=Q3平衡常数为K3 .根据反应①与②推导出K1、K2、K3的关系式K3= , Q1、Q2、Q3的关系式Q3= , 可推断反应③是(填“放”或“吸”)热反应.
(3)、要使反应③在一定条件下建立的平衡右移,可采取的措施有 .A、缩小容器体积 B、扩大容器的体积 C、降低温度E.升高温度 D、使用合适的催化剂(4)、如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:图甲中t2时刻改变的条件可能是 , 图乙中t2时刻改变的条件可能是 .
 17. T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2 , 在催化剂辅助下发生反应:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.
17. T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2 , 在催化剂辅助下发生反应:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.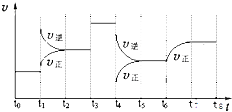
试回答下列问题:
(1)、T℃时,t0时刻,建立平衡后N2的转化率为: , 该反应的平衡常数K= .(2)、t1时刻,改变的外界条件是 .(3)、t4时刻,改变的外界条件是 ,(4)、平衡常数K(t5~t6) K(t7~t8)(填“>、<或=”,下同).分析原因是 .(5)、T℃时,建立平衡后,向容器中加入2molN2和2molNH3 , 则此时 v正 v逆 .