备考2018年高考化学一轮基础复习:专题21 化学反应的方向和限度
试卷更新日期:2017-12-26 类型:一轮复习
一、单选题
-
1. 下列说法正确的是( )A、凡是放热反应都是自发的,由于吸热反应都是非自发的 B、自发反应一定是熵增大,非自发反应一定是熵减少或不变 C、自发反应在恰当条件下才能实现 D、自发反应在任何条件下都能实现2. 下列关于物质“反应程度”的说法正确的是( )A、一定条件下,2 mol SO2与足量O2反应,可制备2 mol SO3 B、一定条件下,1 mol N2与3 mol H2反应,可制备1.0 mol NH3 C、10 mL 18.0 mol/L 的H2SO4与足量铜加热反应,可制备0.09 mol SO2 D、含4 mol HCl的浓盐酸与足量MnO2加热反应,可制备1 mol Cl23. 对于可逆反应2SO2+O2 2SO3 , 在混合气中充入一定量的18O原子,达到平衡以后,18O原子( )A、只存在于O2中 B、只存在于O2和SO2中 C、只存在于O2和SO3中 D、存在于O2、SO2和SO3中4. 在密闭容器中加入2.0mol SO2和1.0mol O2 , 一定条件下发生如下反应2SO2+O2⇌2SO3 . 反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol
n(O2)/mol
n(SO3)/mol
A
1.0
0
1.0
B
0
0
2.0
C
0.2
0.1
1.8
D
1.5
0.75
1.0
A、A B、B C、C D、D5. 一定条件下,在反应:2SO2(g)+O2(g)⇌2SO3(g)的化学平衡体系中,SO2、O2、SO3的浓度分别为2mol•L﹣1、0.8mol•L﹣1、2.4mol•L﹣1 , 则O2在反应起始时可能的浓度范围是( )A、0.8~2.0 mol•L﹣1 B、0~2.0 mol•L﹣1 C、0~0.8 mol•L﹣1 D、无法确定6. 将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应:①2N2O5(g)⇌2N2O4(g)+O2(g);②N2O4(g)⇌2NO2(g).达到平衡时,c(O2)=0.2mol•L﹣1 , c(NO2)=0.6mol•L﹣1 , 则此温度下反应①的平衡常数为( )
A、3.2 B、0.2 C、 D、7. 某温度下,浓度都是1mol•L﹣1的两种气体X2和Y2 , 在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4mol•L﹣1 , c(Y2)=0.6mol•L﹣1 , c(Z)=0.4mol•L﹣1 , 则该反应的化学方程式可表示为( )A、2X2+3Y2⇌2X2Y3 B、3X2+2Y2⇌2X3Y2 C、X2+2Y2⇌XY2 D、2X2+Y2⇌2X2Y8.在密闭容器中进行反应:X(g)+3Y(g)⇌2Z(g),有关下列图象的说法正确的是( )
 A、依据图a可判断正反应为吸热反应 B、在图b中,虚线可表示压强增大 C、若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 D、由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>09. 在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4 , 在一定条件下发生反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
A、依据图a可判断正反应为吸热反应 B、在图b中,虚线可表示压强增大 C、若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 D、由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>09. 在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4 , 在一定条件下发生反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )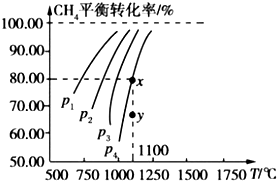 A、1100℃时该反应平衡常数为 1.64 B、压强:p4>p3>p2>p1 C、上述反应的△H<0 D、压强为 p4时,在y点:v 正>v 逆
A、1100℃时该反应平衡常数为 1.64 B、压强:p4>p3>p2>p1 C、上述反应的△H<0 D、压强为 p4时,在y点:v 正>v 逆二、填空题
-
10. “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H>0.已知在1 100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol•L﹣1 , c(CO)=0.1mol•L﹣1 , 则在这种情况下,该反应向进行(填“左”或“右”),判断依据是 .
11. 在一定条件下,可逆反应A2(g)+B2(g)⇌2C(g)达到平衡时,A2、B2和C的浓度分别为0.5mol/L、0.1mol/L、1.6mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:(1)、a、b应满足的关系是 .(2)、a的取值范围是 .12. 可逆反应A(g)+B(g)⇌2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.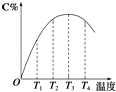
①由T1向T2变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
③反应在温度下达到平衡.
④此反应的正反应为热反应.
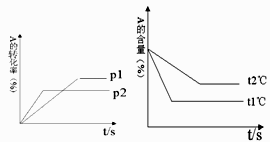
13. 可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:①压强 P1P2;(a+b)(c+d)(填“>”或“<”下同).
②温度t1℃ t2℃;△H0.
③保持体积和温度不变,通入He,平衡会移动(填“正向”、“逆向”或“不”).
 14. 如表表示合成氨反应(N2+3H2⇌2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)═1:3].分析表中数据,回答下列问题:
14. 如表表示合成氨反应(N2+3H2⇌2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)═1:3].分析表中数据,回答下列问题:压强(MPa)
氨的含量
温度(℃)
0.1
10
30
60
100
200
0.153
0.815
0.899
0.954
0.988
300
0.022
0.520
0.710
0.842
0.926
400
0.004
0.251
0.470
0.652
0.798
(1)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是:
(2)欲使平衡混合物中氨的含量增大,则可采取的措施有:
(3)欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:
三、综合题
-
15. 现有一可导热体积固定的密闭容器A,和一可导热容积可变的容器B.关闭K2 , 将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2⇌N2O4;△H<0)
 (1)、一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VAVB . (填“>”、“<”、“=”);若打开活塞K2 , 气球B将(填:变大、变小、不变).(2)、若在A、B中再充入与初始量相等的NO2 , 则达到平衡时,NO2的转化率αA将 (填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 , B中NO2的转化率将(填:变大、变小、不变).(3)、室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,中的颜色较深.(4)、若在容器A中充入4.6g的NO2 , 达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为 .16. 过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图所示.
(1)、一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VAVB . (填“>”、“<”、“=”);若打开活塞K2 , 气球B将(填:变大、变小、不变).(2)、若在A、B中再充入与初始量相等的NO2 , 则达到平衡时,NO2的转化率αA将 (填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 , B中NO2的转化率将(填:变大、变小、不变).(3)、室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,中的颜色较深.(4)、若在容器A中充入4.6g的NO2 , 达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为 .16. 过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图所示. (1)、已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJ•mol﹣1 , C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJ•mol﹣1 . 则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .(2)、用如图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是 .
(1)、已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJ•mol﹣1 , C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJ•mol﹣1 . 则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .(2)、用如图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是 . (3)、在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
(3)、在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:①p1p2(填“>”、“<”或“=”).
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2 , 达到新平衡时,CO的平衡转化率(填“增大”、“减小”或“不变”).

③在p1下,100℃时,CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数为(用含a、V的代数式表示).
(4)、右上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ•mol﹣1)的变化:关于该反应的下列说法中,正确的是 (填编号).
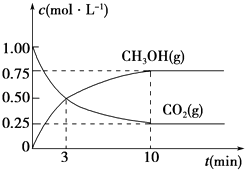
A、△H>0,△S>0 B、△H>0,△S<0 C、△H<0,△S<0 D、△H<0,△S>0(5)、为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:①从反应开始到平衡,CO2的平均反应速率v(CO2)= .
②下列措施中能使化学平衡向正反应方向移动的是(填编号).
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CO2和3mol H2 .