备考2018年高考化学一轮基础复习:专题20 化学反应速率
试卷更新日期:2017-12-26 类型:一轮复习
一、单选题
-
1. 将氯酸钾加热分解,在0.5min内放出5mL氧气,加入二氧化锰后,在同样温度下,0.2min内放出50mL氧气.则加入二氧化锰后的反应速率是未加二氧化锰时反应速率的( )A、10倍 B、25倍 C、50倍 D、250倍2. 下列有关叙述正确的是( )A、常温下,某溶液中水电离出来的c(H+)和c(OH﹣)的乘积为1×10﹣24 , 该溶液中一定可以大量存在K+、Na+、ClO﹣、SO42﹣ B、对N2(g)+3H2(g)⇌2NH3(g),恒温恒容时充入N2 , 正反速率增大,逆反应速率减小 C、已知25℃时,Ksp(AgCl)=1.8×10﹣10 , 则在0.1mol﹣1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10﹣10mol•L﹣1 D、在酸碱中和滴定时,装标准液的滴定管未用标准液润洗直接装入标准液进行滴定,会引起测定结果浓度偏低3. 在2L的密闭容器中,发生如下反应:3A+B⇌2C (A、B、C均为气体),若最初加入的A、B都是4mol,10s内用A表示的平均反应速率为0.12mol/(L•s),则10s后容器中的B的物质的量是( )A、2.8 mol B、1.6 mol C、3.2 mol D、3.6 mol4. 下列措施是为了降低化学反应速率的是( )A、合成氨的反应中,选择“触媒”作催化剂 B、保存浓硝酸时,通常用棕色瓶并放在阴凉处 C、在试管中进行铝和氢氧化钠溶液反应时,稍微加热 D、用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液5. 对于可逆反应3H2+N2⇌2NH3 , 下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )A、使用高效催化剂 B、充入更多N2 C、降低温度 D、增大压强6. 下列四支试管中,过氧化氢分解的化学反应速率最大的是( )
试管
温度
过氧化氢浓度
催化剂
A
室温(25℃)
12%
有
B
水浴加热(50℃)
4%
无
C
水浴加热( 50℃)
12%
有
D
室温(25℃)
4%
无
A、A B、B C、C D、D7. 对于可逆反应A(g)+3B(g)⇌2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•min﹣1 B、v(B)=1.2 mol•L﹣1•s﹣1 C、v(D)=0.4 mol•L﹣1•min﹣1 D、v(C)=0.1 mol•L﹣1•s﹣18.在密闭容器中进行反应:X(g)+3Y(g)⇌2Z(g),有关下列图象的说法正确的是( )
 A、依据图a可判断正反应为吸热反应 B、在图b中,虚线可表示压强增大 C、若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 D、由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>09. 可逆反应N2+3H2 2NH3 , 在体积不变的密闭容器中反应,达到平衡状态的标志是( )A、单位时间内生成n molN2的同时生成n molNH3 B、N2、H2、NH3的物质的量浓度比值为1:3:2 C、v(N2)=v(NH3) D、单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键10. 在一定条件下,反应N2+3H2⇌2NH3在10L恒容密闭容器中进行,测得2min内氮气的物质的量由20mol减少到8mol,则2min内氮气的化学反应速率为( )A、1.2mol•L﹣1•min﹣1 B、0.8mol•L﹣1•min﹣1 C、1.0mol•L﹣1•min﹣1 D、0.6mol•L﹣1•min﹣1
A、依据图a可判断正反应为吸热反应 B、在图b中,虚线可表示压强增大 C、若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 D、由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>09. 可逆反应N2+3H2 2NH3 , 在体积不变的密闭容器中反应,达到平衡状态的标志是( )A、单位时间内生成n molN2的同时生成n molNH3 B、N2、H2、NH3的物质的量浓度比值为1:3:2 C、v(N2)=v(NH3) D、单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键10. 在一定条件下,反应N2+3H2⇌2NH3在10L恒容密闭容器中进行,测得2min内氮气的物质的量由20mol减少到8mol,则2min内氮气的化学反应速率为( )A、1.2mol•L﹣1•min﹣1 B、0.8mol•L﹣1•min﹣1 C、1.0mol•L﹣1•min﹣1 D、0.6mol•L﹣1•min﹣1二、填空题
-
11. 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
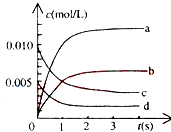
①图中表示NO2变化的曲线是 , 用O2表示从0~2s内该反应的平均速率v= .
②能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
12. 已知A、B、C均为气体,在体积为10L的恒容密闭容器中进行发生可逆反应,在0~3分钟内各物质的量的变化情况如图所示.请回答下列问题: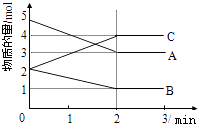
①反应开始至2分钟时,B的平均反应速率为 .
②该反应的化学反应方程式为
③由图求3min时A的转化率为 .
三、综合题
-
13. 氮元素的氢化物和氧化物在工业生产和防建设中都有广泛的应用.请回答下列问题:(1)、氨气可由N2和H2反应制取,N2(g)+3H2(g)⇌2NH3(g)反应过程的能量变化如图所示:已知1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1molN﹣H键时释放390.8kJ的能量.
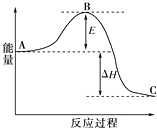
①图中E的大小对该反应热有无影响? . 该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低? , 理由 .
②图中△H=kJ/mol.
③如果反应速率v(H2)为0.15mol/(L•min),则v(N2)=mol/(L•min),v(NH3)= .
(2)、肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.已知:N2(g)+2O2(g)=N2O4(l)?△H=﹣19.5kJ•mol﹣1
N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=﹣534.2kJ•mol﹣1
请写出肼和 N2O4反应的热化学反应方程式 .