河南省新乡市卫辉市2017-2018学年九年级上学期化学期中考试试卷
试卷更新日期:2017-12-25 类型:期中考试
一、单选题
-
1. 下列制作过程中的变化属于化学变化的是( )A、海水晒盐 B、粮食酿酒 C、铁水铸锅 D、麦磨成面2. 下列科学家中,发现了元素周期规律并编制了元素周期表的是( )A、门捷列夫 B、道尔顿 C、阿伏加德罗 D、拉瓦锡3. 下列各项中,不属于我国《环境空气质量标准》基本监控项目的是( )A、SO2浓度 B、NO2浓度 C、CO2浓度 D、PM2.5浓度4. 下列各组物质中,都由分子组成的一组是( )A、水和氯化钠 B、氯化钠和硫酸铜 C、汞和水 D、二氧化碳和水5. 下列各组物质,按混合物、化合物、单质顺序排到的是( )A、冰水、食盐水、氮气 B、石油、煤、天然气 C、空气、二氧化碳、液化氧 D、氧化镁、酒精、水银6. 下列图示的实验操作正确的是( )A、
 取少量液体
B、
取少量液体
B、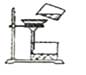 过滤
C、
过滤
C、 闻气体
D、
闻气体
D、 稀释浓硫酸
7. 水是人们生活、生产各方面都离不开的重要物质.下列有关水的说法错误的是( )A、水是一种最常用的溶剂 B、用肥皂水鉴别硬水和软水 C、自然界的水都含有杂质 D、电解是一种净化水的方法8. 下列各组物质在氧气中燃烧,前者产生明亮的蓝紫色火焰,后者有白烟生成的是( )A、镁带、红磷 B、硫粉、红磷 C、蜡烛、木炭 D、纸张、铁丝9. 已知某两种物质在光照条件下能发生化学反应,其微观示意图如下(一种小球代表一种原子):则下列说法正确的是( )
稀释浓硫酸
7. 水是人们生活、生产各方面都离不开的重要物质.下列有关水的说法错误的是( )A、水是一种最常用的溶剂 B、用肥皂水鉴别硬水和软水 C、自然界的水都含有杂质 D、电解是一种净化水的方法8. 下列各组物质在氧气中燃烧,前者产生明亮的蓝紫色火焰,后者有白烟生成的是( )A、镁带、红磷 B、硫粉、红磷 C、蜡烛、木炭 D、纸张、铁丝9. 已知某两种物质在光照条件下能发生化学反应,其微观示意图如下(一种小球代表一种原子):则下列说法正确的是( ) A、化学反应前后各元素的化合价没有改变 B、该反应属于分解反应 C、该反应不符合质量守恒定律 D、图示中共有4种分子10. 科学家发现半胱氨酸(一种氨基酸)能增强艾滋病毒感染者的免疫能力,半胱氨酸的化学式为C3H7NSO2下列说法正确的是 ( )A、半胱氨酸属于氧化物 B、半胱氨酸中碳元素、硫元素和氧元素的质量比为9:8:8 C、半胱氨酸的相对分子质量为131 D、半胱氨酸中硫元素的质量分数最大11. 下列化学用语与含义不相符的是 ( )A、AlCl3一氯化铝 B、钙离子-Ca2+ C、2个氧元素-2O D、2个水分子-2H2O12. 小华一次探究实验中将一小粒金属钠投入盛有蒸馏水的烧杯中,发现反应剧烈,并生成大量气体,则该气体可能是( )A、He B、CH4 C、H2 D、NH313. 已知反应A+B=C+D,且A与B参加反应的总质量为20g,若反应后生成的C和D的质量比为2:3,则生成的C的质量为( )A、8g B、l0g C、12g D、16g14. 把一定质量的甲、乙、丙、丁四种物质故入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法不正确的是( )
A、化学反应前后各元素的化合价没有改变 B、该反应属于分解反应 C、该反应不符合质量守恒定律 D、图示中共有4种分子10. 科学家发现半胱氨酸(一种氨基酸)能增强艾滋病毒感染者的免疫能力,半胱氨酸的化学式为C3H7NSO2下列说法正确的是 ( )A、半胱氨酸属于氧化物 B、半胱氨酸中碳元素、硫元素和氧元素的质量比为9:8:8 C、半胱氨酸的相对分子质量为131 D、半胱氨酸中硫元素的质量分数最大11. 下列化学用语与含义不相符的是 ( )A、AlCl3一氯化铝 B、钙离子-Ca2+ C、2个氧元素-2O D、2个水分子-2H2O12. 小华一次探究实验中将一小粒金属钠投入盛有蒸馏水的烧杯中,发现反应剧烈,并生成大量气体,则该气体可能是( )A、He B、CH4 C、H2 D、NH313. 已知反应A+B=C+D,且A与B参加反应的总质量为20g,若反应后生成的C和D的质量比为2:3,则生成的C的质量为( )A、8g B、l0g C、12g D、16g14. 把一定质量的甲、乙、丙、丁四种物质故入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法不正确的是( ) A、m=2.0,乙可能是催化剂 B、甲和丙是反应物 C、参加反应的甲、丙质量比是1:2 D、丁一定是化合物
A、m=2.0,乙可能是催化剂 B、甲和丙是反应物 C、参加反应的甲、丙质量比是1:2 D、丁一定是化合物二、填空题
-
15. 请从①氢气、②氧气、③氮气、④二氧化碳中选择适当的物质填空(填化学式):空气中体积分数最大的是 ;在炼钢、发射火箭、气割气焊时都用到的物质是 ;16. 下表是元素周期表的一部分。原子序数为9的元素名称为 ;氖的原子结构示意图为 ; 等质量的氧气和氖气中,所含原子数较少的是 。
 17. 煤在空气中燃烧需满足的条件是 ;用分子的相关知识解释煤在空气中燃烧能闻到刺激性气味儿的原因是 。18. 某新型净水剂X可以由下列反应制取:Cl2+2NaClO2=2NaCl+2X,则X的化学式为 ,NaClO2中氯元素的化合价为 ,NaCl的构成粒子是(填化学符号)。
17. 煤在空气中燃烧需满足的条件是 ;用分子的相关知识解释煤在空气中燃烧能闻到刺激性气味儿的原因是 。18. 某新型净水剂X可以由下列反应制取:Cl2+2NaClO2=2NaCl+2X,则X的化学式为 ,NaClO2中氯元素的化合价为 ,NaCl的构成粒子是(填化学符号)。
三、简答题
-
19. 甲、乙、丙三种物质均含有氧元素。申、乙是组成元素完全相同的化合物,丙是单质;乙通常为液体,在一定条件下可分解成丙;它们之间有如右图所示的转化关系。则:甲的化学式为 ;乙分解生成丙的化学方程式为。
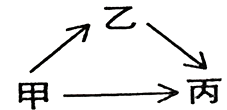
从微观的角度解释甲、乙性质有差异的原因是 。
20. 下图是制取水煤气反应的微观过程,图中反应前后各元素的原子个数 ,生成物中的化合物是 (填名称);化学方程式为 。 21. 为验证质量守恒定律,某同学设计了下图实验,该实验能否达到实验目的?请说明理由(注:大理石与稀盐酸反稀盐酸应有二氧化碳气体生成,二氧化碳与石灰水反应有沉淀产生)。
21. 为验证质量守恒定律,某同学设计了下图实验,该实验能否达到实验目的?请说明理由(注:大理石与稀盐酸反稀盐酸应有二氧化碳气体生成,二氧化碳与石灰水反应有沉淀产生)。 22.(1)、按下图装置做测定空气中氧气含量的实验要达到目的,反应物或装置方面应满足的条件是什么?(答出一条即可)
22.(1)、按下图装置做测定空气中氧气含量的实验要达到目的,反应物或装置方面应满足的条件是什么?(答出一条即可) (2)、写出该实验中红磷燃烧的化学方程式。23. 请用化学方程式表示下列反应原理。(1)、小明点燃木炭为烧烤做准备。(2)、某金属在氧气中燃烧,现象为剧烈燃烧,火星四射。(3)、镁粉常用于照明弹。24. 某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用A装置来制氧气。
(2)、写出该实验中红磷燃烧的化学方程式。23. 请用化学方程式表示下列反应原理。(1)、小明点燃木炭为烧烤做准备。(2)、某金属在氧气中燃烧,现象为剧烈燃烧,火星四射。(3)、镁粉常用于照明弹。24. 某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用A装置来制氧气。 (1)、实验中,同学们发现不能得到平稳的氧气流。大家提出两个方面的改进意见:一是把发生装置由A改为B,这一改进的优点是什么?二是将过氧化氢溶液加水稀释,这又是为什么?(2)、如果选用C装置收集一瓶较纯净的氧气,具体应该如何操作?
(1)、实验中,同学们发现不能得到平稳的氧气流。大家提出两个方面的改进意见:一是把发生装置由A改为B,这一改进的优点是什么?二是将过氧化氢溶液加水稀释,这又是为什么?(2)、如果选用C装置收集一瓶较纯净的氧气,具体应该如何操作?
25. 氧气在日常生活和T业生产中的用途非常广泛,其实验室的制取是化学研究的重要内容。(1)、根据下列实验装置图回答问题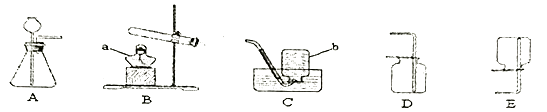
①写出标有字母的仪器名称:a ,b 。
②写出A装置制取O2的化学方程式 。
③若装置D收集氧气,验满的方法是 。
(2)、实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程式: ;(3)、小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:【提出猜想】除MnO2 , CuO外,Fe2O3 , 也可以作KClO3分解的催化剂。
【实验验证】按下表进行实验:经测定分解温度(分解温度越低,催化效果越好)。
实验编号
实验药品
分解温度( )
①
KClO3
580
②
KClO3、MnO2质量比1:1)
350
③
KClO3 , CuO(质量比1:1)
370
④
KClO3、Fe2O3(质量比1:1)
390
【分析数据、得出结论】由实验与实验④对比,证明猜想合理。
(4)、【拓展延伸】如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?(5)、【实验反思】同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证 。(6)、在实验室中用高锰酸钾制取氧气,若产生9.6克氧气需要分解克高锰酸钾?