2015-2016学年浙江省宁波市镇海区九年级上学期期末科学(化学部分)试卷
试卷更新日期:2016-10-18 类型:期末考试
一、选择题
-
1. 日常生活里常见的下列饮品中,可能不含有机物的是( )A、果汁 B、牛奶 C、矿泉水 D、啤酒2.
小科在碳酸钠的溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液,在该实验过程的操作如图所示,下列有关操作与目的分析均正确的是( )
 A、甲中试剂瓶标签正对手心,是为了防止手被腐蚀 B、乙中将滴管伸入试管内,是为了防止试剂滴落到试管外 C、丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染 D、戊中将水缓慢倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅3. 如图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.下列能说明CO2密度大于空气且能与水反应的现象是( )
A、甲中试剂瓶标签正对手心,是为了防止手被腐蚀 B、乙中将滴管伸入试管内,是为了防止试剂滴落到试管外 C、丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染 D、戊中将水缓慢倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅3. 如图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.下列能说明CO2密度大于空气且能与水反应的现象是( )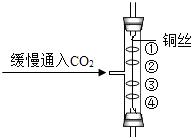 A、①变红,③不变红 B、④变红,③不变红 C、①、④变红,②、③不变红 D、④比①先变红,②、③不变红4.
A、①变红,③不变红 B、④变红,③不变红 C、①、④变红,②、③不变红 D、④比①先变红,②、③不变红4.建立模型是学习科学的重要方法,在理解化学反应的本质时往往引入模型.如图是某反应的微观模型,有关该模型的叙述中,正确的是( )
 A、该反应是分解反应 B、反应前后原子种类发生改变 C、
A、该反应是分解反应 B、反应前后原子种类发生改变 C、 相对分子质量为44g
D、
相对分子质量为44g
D、 是保持氧气化学性质的微粒
5. 以下四组离子,有一组能大量共存且能形成无色透明溶液,它应该是( )A、Fe3+、SO 、H+、Cl﹣ B、Mg2+、Cl﹣、OH﹣、Na+ C、H+、Ba2+、NO 、SO D、H+、Na+、K+、NO6. 将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混和溶液中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法中,不合理的是( )A、滤液M中一定存在Fe2+ B、滤渣N的质量一定小于加入铁粉的质量 C、滤渣N中一定没有单质镁 D、滤液M中至少含有两种金属阳离子7. 在一密闭容器中加入甲、乙、丙、丁四种物质,在运动条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中不正确的是( )
是保持氧气化学性质的微粒
5. 以下四组离子,有一组能大量共存且能形成无色透明溶液,它应该是( )A、Fe3+、SO 、H+、Cl﹣ B、Mg2+、Cl﹣、OH﹣、Na+ C、H+、Ba2+、NO 、SO D、H+、Na+、K+、NO6. 将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混和溶液中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法中,不合理的是( )A、滤液M中一定存在Fe2+ B、滤渣N的质量一定小于加入铁粉的质量 C、滤渣N中一定没有单质镁 D、滤液M中至少含有两种金属阳离子7. 在一密闭容器中加入甲、乙、丙、丁四种物质,在运动条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中不正确的是( ) A、该反应为化合反应 B、丙可能为该反应的催化剂 C、该反应中,乙、丁的质量变化之比为7:5 D、该反应中,甲、乙的质量变化之比为1:4
A、该反应为化合反应 B、丙可能为该反应的催化剂 C、该反应中,乙、丁的质量变化之比为7:5 D、该反应中,甲、乙的质量变化之比为1:4二、综合题
-
8. 归纳总结是学习化学的重要方法,下面是某同学对有关知识的总结,请你完成填空.(1)、逻辑关系:物质类属间存在着如下关系,其中酸和盐属于关系.
 (2)、转化关系:下图表示几种化合物能通过一步反应转化为含镁化合物M.
(2)、转化关系:下图表示几种化合物能通过一步反应转化为含镁化合物M.
上图中物质M属于(选填“单质”、“氧化物”、“酸”、“碱”或“盐”);
从①~③表示的化学反应中任选一个,写出化学方程式:
9. 小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定,取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图象. (1)、滴加的溶液中溶质属于(选填“盐”或“碱”).(2)、图象中的a点数值时 .(3)、图象横坐标中的b点表示的溶液的质量是克.10. 实验室制氧气的两种方法如下:
(1)、滴加的溶液中溶质属于(选填“盐”或“碱”).(2)、图象中的a点数值时 .(3)、图象横坐标中的b点表示的溶液的质量是克.10. 实验室制氧气的两种方法如下:方法一:用过氧化氢溶液在二氧化锰作催化剂的条件下制取氧气;
方法二:用二氧化锰作催化剂,加热分解氯酸钾制取氧气.
(1)、写出方法一制取氧气反应的化学方程式:;(2)、下图是实验室用于制取、干燥和收集气体的装置图,现用方法一制取一瓶干燥的氧气,请按气体流向,用导管的编号将装置连接好 . 11. 氢气还原氧化铜生成红色固体,这些红色固体是什么物质?某科学兴趣小组查阅资料得知,反应温度不同,氢气还原氧化铜的产物可能是Cu或Cu2O,Cu和Cu2O均为不溶于水的红色固体:但氧化亚铜能与稀硫酸反应,化学方程式为:Cu2O+H2SO4═CuSO4+Cu+H2O.为探究反应后红色固体中含有什么物质?它们提出了以下假设:
11. 氢气还原氧化铜生成红色固体,这些红色固体是什么物质?某科学兴趣小组查阅资料得知,反应温度不同,氢气还原氧化铜的产物可能是Cu或Cu2O,Cu和Cu2O均为不溶于水的红色固体:但氧化亚铜能与稀硫酸反应,化学方程式为:Cu2O+H2SO4═CuSO4+Cu+H2O.为探究反应后红色固体中含有什么物质?它们提出了以下假设:假设一:红色固体只有Cu
假设二:红色固体只有Cu2O
假设三:红色固体中有Cu和Cu2O
请回答有关问题.
(1)、取少量红色固体,加入足量的稀硫酸.若无明显现象,则假设成立;(2)、现将3克红色固体加入足量的稀硫酸中,反应后的溶液过滤,称得烘干后的滤渣质量为1.4克,则原红色固体中含有什么物质? .12. 某溶液中可能含有碳酸钠、硫酸钠、盐酸中的一种或几种,取样,进行如下实验,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀质量与时间的关系如下图所示: (1)、由上述实验可知,AB之间图象所对应的溶液中的溶质一定有;(2)、BC段沉淀减少的原因是(用化学方程式表示);(3)、C点沉淀质量为B点沉淀质量的三分之一,则原混合物中碳酸根离子、硫酸根离子的个数之比为 .A、2:1 B、197:466 C、1:2 D、466:197.13. 出生于中国宁波的女医药家屠呦呦,因发现并提取出青蒿素(化学式为C15H22O5)而获得2015年诺贝尔生理学或医学奖.她发现的青蒿素用于治疗疟疾,挽救了全球特别是发展中国家数百万人的生命.(1)、青蒿素含有由种元素;(2)、青蒿素的相对分子质量是;(3)、青蒿素分子中其中碳、氢、氧的原子个数比为 .14. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔.
(1)、由上述实验可知,AB之间图象所对应的溶液中的溶质一定有;(2)、BC段沉淀减少的原因是(用化学方程式表示);(3)、C点沉淀质量为B点沉淀质量的三分之一,则原混合物中碳酸根离子、硫酸根离子的个数之比为 .A、2:1 B、197:466 C、1:2 D、466:197.13. 出生于中国宁波的女医药家屠呦呦,因发现并提取出青蒿素(化学式为C15H22O5)而获得2015年诺贝尔生理学或医学奖.她发现的青蒿素用于治疗疟疾,挽救了全球特别是发展中国家数百万人的生命.(1)、青蒿素含有由种元素;(2)、青蒿素的相对分子质量是;(3)、青蒿素分子中其中碳、氢、氧的原子个数比为 .14. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔. (1)、小柯用放置很久的铝箔与 稀盐酸反应,产生氢气质量和反应时间关系如图所示.在0~t1时间段内,铝箔表面看不到明显的气泡,原因是 . 在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余.t2~t3时间段产生气泡速度放缓的原因是 .(2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克.则样品中单质铝的质量分数为 .15. 三位同学分别用相同质量分数的稀盐酸,测定某石灰石样品中碳酸钙的质量分数(石灰石的杂质既不与酸反应,也不溶于水)(1)、小敏的方法可用如下流程表示,测得的碳酸钙的质量分数为;
(1)、小柯用放置很久的铝箔与 稀盐酸反应,产生氢气质量和反应时间关系如图所示.在0~t1时间段内,铝箔表面看不到明显的气泡,原因是 . 在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余.t2~t3时间段产生气泡速度放缓的原因是 .(2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克.则样品中单质铝的质量分数为 .15. 三位同学分别用相同质量分数的稀盐酸,测定某石灰石样品中碳酸钙的质量分数(石灰石的杂质既不与酸反应,也不溶于水)(1)、小敏的方法可用如下流程表示,测得的碳酸钙的质量分数为;
他在过滤操作中,需要用到的玻璃仪器有(选填序号)
A.酒精灯、漏斗玻璃棒 B.漏斗、玻璃棒、烧杯 C.酒精灯、试管、玻璃棒
(2)、小华取10克样品,用如图甲实验装置进行实验,反应结束后,测得B装置质量增加了4.6克,算得碳酸钙的质量分数,发现与事实严重不符,造成这种情况的可能原因是 . (3)、小军用如图乙的实验装置进行实验,将20克稀盐酸加入到1.25克样品中,生成的CO2体积与反应时间的关系如图丙,已知本实验条件下CO2的密度为1.8克/升,则该石灰石样品中CaCO3的质量分数为 .(4)、求实验所用的稀盐酸溶质质量分数.
(3)、小军用如图乙的实验装置进行实验,将20克稀盐酸加入到1.25克样品中,生成的CO2体积与反应时间的关系如图丙,已知本实验条件下CO2的密度为1.8克/升,则该石灰石样品中CaCO3的质量分数为 .(4)、求实验所用的稀盐酸溶质质量分数.