备考2018年高考化学一轮基础复习:专题19 电解池 金属的腐蚀与防护
试卷更新日期:2017-12-15 类型:一轮复习
一、单选题
-
1. 下列叙述的方法不正确的是( )A、金属的电化学腐蚀比化学腐蚀更普遍 B、用铝质铆钉铆接铁板,铁板易被腐蚀 C、钢铁在干燥空气中不易被腐蚀 D、用牺牲锌块的方法来保护船身2. 下列方法中不能用于金属防腐处理的是( )A、制成不锈钢 B、把金属制品埋入潮湿、疏松的土壤中 C、喷油漆、涂油脂 D、电镀3. pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH<a,则该电解质可能是( )A、NaOH B、H2SO4 C、Na2CO3 D、Na2SO44. 有人用全钒液流电池:VO2++V2++2H+ VO2++H2O+V3+ , 在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢,电解总方程式为3H2O+3O2═3H2O2+O3 , 其中H2O2只为还原产物.下列说法正确的是( )A、原电池放电时正极反应为VO2++2H++e﹣═VO2++H2O B、充电时阴极反应为V2+﹣e﹣═V3+ C、电解池的阴极反应式为3O2+6H2O+6e﹣═3H2O2+6OH﹣ D、电解池中生成22.4 L O3(标准状况)时,转移3 mol电子5. 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
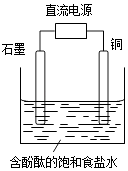 A、石墨电极附近溶液呈红色 B、铜电极上发生还原反应 C、溶液中的Na+向石墨电极移动 D、铜电极附近观察到黄绿色气体6. 如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )
A、石墨电极附近溶液呈红色 B、铜电极上发生还原反应 C、溶液中的Na+向石墨电极移动 D、铜电极附近观察到黄绿色气体6. 如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )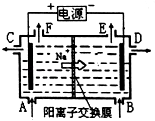 A、标准状况下,生成22.4LCl2的同时有2molNaOH生成 B、从C口流出的是NaOH溶液 C、从E口逸出的气体是H2 D、从F口逸出的气体是Cl27. 列反应的离子方程式正确的是( )A、用铂作电极电解MgCl2溶液:2Cl﹣+2H2O H2↑+Cl2↑+2OH﹣ B、以铜做电极电解硫酸铜溶液:2Cu2++2H2O 4H++2Cu+O2↑ C、甲烷/KOH燃料电池正极反应:O2+4H++4e﹣═2H2O D、高铁电池 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O8. 将0.2mol AgNO3、0.4mol Cu(NO3)2、0.6mol KCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3mol Cu,此时在另一极上产生的气体体积(标准状况)为( )A、3.36 L B、4.48 L C、5.6 L D、6.72 L9. 图中乙是甲的电解池进行电解时的某个量(纵坐标x)随时间变化的曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),则x表示( )
A、标准状况下,生成22.4LCl2的同时有2molNaOH生成 B、从C口流出的是NaOH溶液 C、从E口逸出的气体是H2 D、从F口逸出的气体是Cl27. 列反应的离子方程式正确的是( )A、用铂作电极电解MgCl2溶液:2Cl﹣+2H2O H2↑+Cl2↑+2OH﹣ B、以铜做电极电解硫酸铜溶液:2Cu2++2H2O 4H++2Cu+O2↑ C、甲烷/KOH燃料电池正极反应:O2+4H++4e﹣═2H2O D、高铁电池 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O8. 将0.2mol AgNO3、0.4mol Cu(NO3)2、0.6mol KCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3mol Cu,此时在另一极上产生的气体体积(标准状况)为( )A、3.36 L B、4.48 L C、5.6 L D、6.72 L9. 图中乙是甲的电解池进行电解时的某个量(纵坐标x)随时间变化的曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),则x表示( )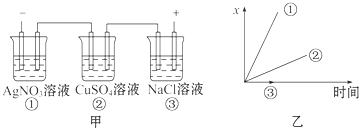 A、各电解池析出气体体积总数的变化 B、各电解池阳极质量的增加 C、各电解池阴极质量的增加 D、各电极上放电的离子总数的变化10. 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )
A、各电解池析出气体体积总数的变化 B、各电解池阳极质量的增加 C、各电解池阴极质量的增加 D、各电极上放电的离子总数的变化10. 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )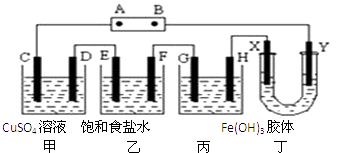 A、电源B 极的名称是负极,丁中Y极附近颜色变深 B、乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 C、设甲池中溶液的体积在电解前后都是500mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L D、甲装置中电解反应的总化学方程式是:CuSO4+Fe Cu+FeSO4
A、电源B 极的名称是负极,丁中Y极附近颜色变深 B、乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 C、设甲池中溶液的体积在电解前后都是500mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L D、甲装置中电解反应的总化学方程式是:CuSO4+Fe Cu+FeSO4二、填空题
-
11. 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,(填X或Y)电极附近先变红色,X极上的电极反应式为 .
②若要在铁制品上镀一定厚度的Cu层,Y电极反应式为
③若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到11.2L氯气时(标准状况),阴极增重32g.该金属的相对原子质量是 .
12. 利用如图装置,可以模拟铁的电化学防护.若X为铜,为减缓铁的腐蚀,开关K应置于 处.铁棒上发生的电极反应为 , 该种防护方法称为若X为锌棒,开关K置于处,铁棒上的电极反应为该电化学防护法称为 .

三、综合题
-
13. 如图为以惰性电极进行电解的装置:
 (1)、写出A、B、C、D各电极上的电极反应式和总反应方程式:
(1)、写出A、B、C、D各电极上的电极反应式和总反应方程式:A: , B: , 总反应方程式:;
C: , D: , 总反应方程式: .
(2)、在A、B、C、D各电极上析出生成物的物质的量之比为 .(3)、A极发生反应,B极发生反应.(填“氧化”或是“还原”)14.如图所示水槽中试管内有一枚铁钉,放置数天后观察:
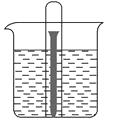 (1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,电极反应式为:负极: , 正极:。(3)、若试管内液面下降,则原溶液呈性,发生腐蚀。电极反应式为,负极: , 正极:。15. 某些电镀厂的酸性废水中常含有一定量的CrO42﹣和Cr2O72﹣ , 它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种
(1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,电极反应式为:负极: , 正极:。(3)、若试管内液面下降,则原溶液呈性,发生腐蚀。电极反应式为,负极: , 正极:。15. 某些电镀厂的酸性废水中常含有一定量的CrO42﹣和Cr2O72﹣ , 它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种方法1:还原沉淀法,其中第①步存在平衡步存在平衡:2CrO42﹣(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O
(1)、若平衡体系的pH=12,该溶液显 .(2)、写出第③步的离子反应方程式: .(3)、第②步中,用6mol的FeSO4•7H2O可还原molCr2O72﹣离子.(4)、第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3() Cr3+(aq)+3OH﹣(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至 .
方法2:电解法:该法用Fe做电极电解含Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)、写出阳极的电极反应式 .(6)、在阴极附近溶液pH升高的原因是(用电极反应解释)(7)、用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为 .