备考2018年高考化学一轮基础复习:专题18 原电池 化学电源
试卷更新日期:2017-12-15 类型:一轮复习
一、单选题
-
1. 图中乙是甲的电解池进行电解时的某个量(纵坐标x)随时间变化的曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),则x表示( )
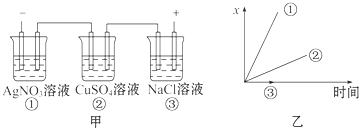 A、各电解池析出气体体积总数的变化 B、各电解池阳极质量的增加 C、各电解池阴极质量的增加 D、各电极上放电的离子总数的变化2. 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
A、各电解池析出气体体积总数的变化 B、各电解池阳极质量的增加 C、各电解池阴极质量的增加 D、各电极上放电的离子总数的变化2. 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )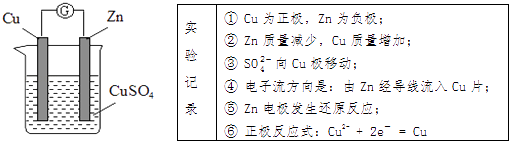 A、②③④ B、①②④⑥ C、①②④⑤ D、②③⑤⑥3. 氢氧燃料电池用于航天飞机,以30%KOH溶液为电解质溶液的这种电池在使用时,下列说法错误的是( )A、H2在负极发生的电极反应是:2H2+4OH﹣﹣4e﹣═4H2O B、供电时的总反应为:2H2+O2═2H2O C、O2正极的电极反应是:O2+2H2O+4e﹣═4OH﹣ D、燃料电池的能量转化率可达100%4. 铁镍蓄电池又称爱迪生电池.放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2 . 下列有关该电池的说法错误的是( )A、电池的电解液为碱性溶液,负极为Fe B、电池放电时,负极反应为Fe+2OH﹣﹣2e﹣═Fe(OH)2 C、电池充电过程中,阴极附近溶液的pH减小 D、电池充电时,OH﹣向阳极迁移5. 利用人工光合作用合成甲酸的原理为2CO2+2H2O⇌2HCOOH+O2 , 装置如图所示,下列说法不正确的是( )
A、②③④ B、①②④⑥ C、①②④⑤ D、②③⑤⑥3. 氢氧燃料电池用于航天飞机,以30%KOH溶液为电解质溶液的这种电池在使用时,下列说法错误的是( )A、H2在负极发生的电极反应是:2H2+4OH﹣﹣4e﹣═4H2O B、供电时的总反应为:2H2+O2═2H2O C、O2正极的电极反应是:O2+2H2O+4e﹣═4OH﹣ D、燃料电池的能量转化率可达100%4. 铁镍蓄电池又称爱迪生电池.放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2 . 下列有关该电池的说法错误的是( )A、电池的电解液为碱性溶液,负极为Fe B、电池放电时,负极反应为Fe+2OH﹣﹣2e﹣═Fe(OH)2 C、电池充电过程中,阴极附近溶液的pH减小 D、电池充电时,OH﹣向阳极迁移5. 利用人工光合作用合成甲酸的原理为2CO2+2H2O⇌2HCOOH+O2 , 装置如图所示,下列说法不正确的是( )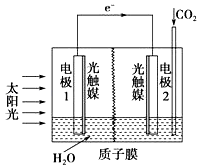 A、该装置将太阳能转化为化学能和电能 B、电极1周围pH减小 C、电极2上发生的反应为CO2+2H++2e﹣═HCOOH D、H+由电极2室经过质子膜流向电极1室6. 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
A、该装置将太阳能转化为化学能和电能 B、电极1周围pH减小 C、电极2上发生的反应为CO2+2H++2e﹣═HCOOH D、H+由电极2室经过质子膜流向电极1室6. 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )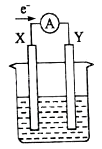 A、外电路的电流方向为:X→外电路→Y B、若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn C、若两电极都是金属,则它们的活动性为 X>Y D、X 极上发生的是还原反应,Y 极上发生的是氧化反应7. 某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液).下列说法正确的是( )
A、外电路的电流方向为:X→外电路→Y B、若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn C、若两电极都是金属,则它们的活动性为 X>Y D、X 极上发生的是还原反应,Y 极上发生的是氧化反应7. 某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液).下列说法正确的是( )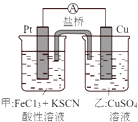 A、该原电池的正极反应是Cu2++2e﹣=Cu B、甲烧杯中溶液的血红色逐渐变浅 C、盐桥中的SO42﹣流向甲烧杯 D、若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转8. 已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2有关其说法正确的是( )A、充电过程是化学能转化为电能的过程 B、放电时负极附近溶液的碱性不变 C、放电时电解质溶液中的OH﹣向正极移动 D、充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣=NiOOH+H2O
A、该原电池的正极反应是Cu2++2e﹣=Cu B、甲烧杯中溶液的血红色逐渐变浅 C、盐桥中的SO42﹣流向甲烧杯 D、若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转8. 已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2有关其说法正确的是( )A、充电过程是化学能转化为电能的过程 B、放电时负极附近溶液的碱性不变 C、放电时电解质溶液中的OH﹣向正极移动 D、充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣=NiOOH+H2O二、填空题
-
9. 最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应式为 4NH3+3O2═2N2+6H2O 你认为电解质溶液应显性(填“酸性”“中性““碱性”),写出正极的电极反应方程式: .10.
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景.
(1)已知H2、CO和CH3OCH3的燃烧热(△H)分别为﹣285.5kJ/mol、﹣283kJ/mol和﹣1460.0kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2 , 将悬浮物带到水面,利于除去.实验室以二甲醚燃料电池模拟该方法设计的装置如图所示:
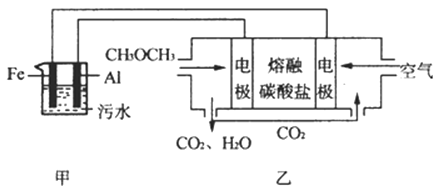
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极.写出该燃料电池的正极电极反应式 下列物质可用做电池熔融碳酸盐的是
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式:
③已知常温下Kap[Fe(OH)3]=4.0×10﹣38 , 电解一段时间后,甲装置中c(Fe3+)=
④已知:H2S的电离平衡常数:K1=9.1×10﹣8、K2=1.1×10﹣12;H2CO3的电离平衡常数:K1=4.31×10﹣7、K2=5.61×10﹣11 . 测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2﹣+H2O═CO32﹣+H2S
B.发生反应的离子方程式为:CO2+S2﹣+H2O═HCO3﹣+HS﹣
C.c(Na+)=2[c(H2S)+c(HS﹣)+c(S2﹣)]
D.c(Na+)+c(H+)=2c(CO32﹣)+2c(S2﹣)+c(OH﹣)
E.c(Na+)>c(HCO3﹣)>c(HS﹣)>c(OH﹣)
三、综合题
-
11. 如图电解装置中,电极A是由金属M制成的,B、C和D都是铂电极,甲中的电解质溶液为MSO4 , 乙中的电解质为H2SO4 . E、F是外接直流电源的两极,电路接通后,电极B上有金属M析出.(已知金属M无变价)
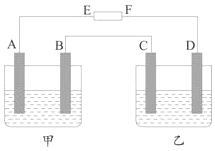 (1)、电池中E是极,F是极.(2)、A极上电极反应为 , B极上电极反应为 , C极上电极反应为 , D极上电极反应为 .(3)、当电路中通过2.408×1022个电子时停止电解,发现B极上析出1.27gM,则金属M的相对原子质量为 .(4)、如果再将外接直流电源的正负极交换接入原电路,当通过1mol电子后,B极的电极反应为 .12. 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
(1)、电池中E是极,F是极.(2)、A极上电极反应为 , B极上电极反应为 , C极上电极反应为 , D极上电极反应为 .(3)、当电路中通过2.408×1022个电子时停止电解,发现B极上析出1.27gM,则金属M的相对原子质量为 .(4)、如果再将外接直流电源的正负极交换接入原电路,当通过1mol电子后,B极的电极反应为 .12. 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题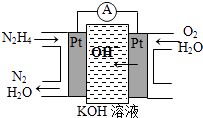 (1)、肼燃料电池原理如图所示,N2H4通入的一极应为电池的极(填“正”或“负”).(2)、火箭常用N2O4作氧化剂,肼作燃料,已知:
(1)、肼燃料电池原理如图所示,N2H4通入的一极应为电池的极(填“正”或“负”).(2)、火箭常用N2O4作氧化剂,肼作燃料,已知:N2(g)+2O2(g)═2NO2(g)△H=﹣67.7kJ•mol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJ•mol﹣1
2NO2(g)⇌N2O4(g)△H=﹣52.7kJ•mol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(3)、联氨的工业生产常用氨和次氯酸钠为原料获得,也可用尿素[CO(NH2)2]和次氯酸钠﹣氢氧化钠溶液反应获得,请写出尿素法反应的离子方程式为 .13.锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害.对废旧电池进行资源化处理显得非常重要.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源.
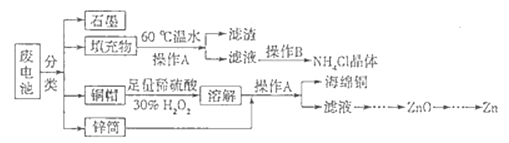
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是
(3)操作A的名称为
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2 .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收.在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图所示:
根据图可知:

①pH对Hg吸收率的影响规律是
②在强酸性环境下Hg的吸收率高的原因可能是