备考2018年高考化学一轮基础复习:专题17 化学反应中的热效应
试卷更新日期:2017-12-15 类型:一轮复习
一、单选题
-
1. 已知:P4(g)+6Cl2(g)═4PCl3(g)△H=a kJ•mol﹣1 , P4(g)+10Cl2(g)═4PCl5(g)△H=bkJ•mol﹣1 , P4具有正四面体结构,PCl5中P﹣Cl键的键能为c kJ•mol﹣1 , PCl3中P﹣Cl键的键能为1.2c kJ•mol﹣1 . 下列叙述正确的是( )A、P﹣P键的键能大于P﹣Cl键的键能 B、可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H C、Cl﹣Cl键的键能为 (b﹣a+5.6c)/4 kJ•mol﹣1 D、磷元素的非金属性比氯强2. 下列过程放出热量的是( )A、液氨气化 B、钠与水反应 C、碳酸钙分解 D、化学键的断裂3. 反应CH3OH ( l )+NH3( g )═CH3NH2( g )+H2O ( g )在某温度自发向右进行,若反应|△H|=17kJ/mol,|△H﹣T△S|=17kJ/mol,对于该反应下列关系正确的是( )A、△H>0,△H﹣T△S<0 B、△H<0,△H﹣T△S>0 C、△H>0,△H﹣T△S>0 D、△H<0,△H﹣T△S<04. 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 A、该反应为放热反应 B、催化剂能改变反应的焓变 C、逆反应的活化能大于正反应的活化能 D、催化剂能降低反应的活化能5. 以NA表示阿伏加德罗常数,则关于热化学方程式:C2H2(g)+ O2(g)═2CO2(g)+H2O(l)△H=﹣1300kJ•mol﹣1的说法中,正确的是( )A、当有6 NA个电子转移时,该反应放出1300 kJ的能量 B、当有NA个水分子生成且为液体时,吸收1300 kJ的能量 C、当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量 D、当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量6. 下列依据热化学方程式得出的结论正确的是( )A、若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1 , 则20.0g NaOH固体与稀盐酸完全中和,放出28.65 kJ的热量 C、因为热化学方程式中的化学计量数只表示物质的量,所以化学计量数可以是分数 D、若2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ•mol﹣1 , 则H2燃烧热为241.8 kJ•mol﹣17. 已知在25℃、101kPa下,1g C8H18(l)燃烧生成CO2和液态H2O时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )A、C8H18(l)+ O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJ•mol﹣1 B、C8H18(l)+ O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJ•mol﹣1 C、C8H18(l)+ O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol﹣1 D、2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=﹣5 517.6 kJ•mol﹣18. 已知下列反应的反应热:
A、该反应为放热反应 B、催化剂能改变反应的焓变 C、逆反应的活化能大于正反应的活化能 D、催化剂能降低反应的活化能5. 以NA表示阿伏加德罗常数,则关于热化学方程式:C2H2(g)+ O2(g)═2CO2(g)+H2O(l)△H=﹣1300kJ•mol﹣1的说法中,正确的是( )A、当有6 NA个电子转移时,该反应放出1300 kJ的能量 B、当有NA个水分子生成且为液体时,吸收1300 kJ的能量 C、当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量 D、当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量6. 下列依据热化学方程式得出的结论正确的是( )A、若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1 , 则20.0g NaOH固体与稀盐酸完全中和,放出28.65 kJ的热量 C、因为热化学方程式中的化学计量数只表示物质的量,所以化学计量数可以是分数 D、若2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ•mol﹣1 , 则H2燃烧热为241.8 kJ•mol﹣17. 已知在25℃、101kPa下,1g C8H18(l)燃烧生成CO2和液态H2O时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )A、C8H18(l)+ O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJ•mol﹣1 B、C8H18(l)+ O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJ•mol﹣1 C、C8H18(l)+ O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol﹣1 D、2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=﹣5 517.6 kJ•mol﹣18. 已知下列反应的反应热:( 1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJ•mol﹣1
( 2)C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ•mol﹣1
( 3)H2(g)+O2(g)═H2O(l)△H3=﹣285.8kJ•mol﹣1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
A、△H=+488.3 kJ•mol﹣1 B、△H=﹣244.15 kJ•mol﹣1 C、△H=﹣977.6 kJ•mol﹣1 D、△H=﹣488.3 kJ•mol﹣1二、填空题
-
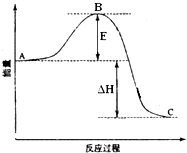
9. 25℃、101kPa时,纯物质完全燃烧生成时所放出的热量,叫做该物质的燃烧热.10. 已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为 .11. 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJ•mol﹣1 . 请回答下列问题:
图中A表示 , E的大小对该反应的反应热(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H(填“变大”、“变小”或“不变”).图中△H=kJ•mol﹣1 .
 12. 化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等.
12. 化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等.(1)下列△H表示物质标准燃烧热的是 ;表示中和反应反应热的是 .(填“△H1”、“△H2”、“△H3”等)
A.2H2(g)+O2(g)═2H2O(l)△H1B.C(s)+O2(g)═CO(g)△H2=﹣Q1kJ•mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3D.C(s)+O2(g)═CO2(g)△H4=﹣Q2kJ•mol﹣1
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式: .
(3)根据题(1)中B、D判断1molCO(g)完全燃烧的△H= .
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是 ;从实验装置上看,图中尚缺少的一种玻璃用品是 ;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值 (填“偏大”“偏小”或“无影响”).

三、综合题
-
13. 根据问题填空:(1)、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.8kJ的热量(相当于25℃、101kPa下测得的热量).
①反应的热化学方程式为 .
②又已知H2O(l)═H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(2)、已知热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJ•mol﹣1②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJ•mol﹣1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol﹣1
写出FeO(s)被CO还原生成Fe和CO2的热化学方程式: .
(3)、已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol﹣1 , 1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ.14. 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题: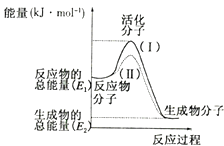 (1)、图中所示反应是(填“吸热”或“放热”)反应,该反应的△H=(用含E1、E2的代数式表示).(2)、下列4个反应中符合示意图描述的反应的是 (填代号).A、水蒸气与炭反应 B、用水稀释氢氧化钠溶液 C、铝粉与Fe2O3反应 D、灼热的碳与CO2反应(3)、已知热化学方程式:H2(g)+ O2 (g)=H2O(g)△H=﹣241.8kJ/mol.该反应的活化能为167.2kJ/mo1,则其逆反应的活化能为 .(4)、以甲烷为原料制取氢气是工业上常用的制氢方法.已知:
(1)、图中所示反应是(填“吸热”或“放热”)反应,该反应的△H=(用含E1、E2的代数式表示).(2)、下列4个反应中符合示意图描述的反应的是 (填代号).A、水蒸气与炭反应 B、用水稀释氢氧化钠溶液 C、铝粉与Fe2O3反应 D、灼热的碳与CO2反应(3)、已知热化学方程式:H2(g)+ O2 (g)=H2O(g)△H=﹣241.8kJ/mol.该反应的活化能为167.2kJ/mo1,则其逆反应的活化能为 .(4)、以甲烷为原料制取氢气是工业上常用的制氢方法.已知:CH4 (g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2 (g)△H=+247.4kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
15. 把煤作为燃料可以通过下列两种途径:途径I:C(s)+O2(g) CO2(g)(放热Q1J)
途径II:先制水煤气:C(s)+H2O(g)═CO(g)+H2(g)(吸热Q2J)再燃烧水煤气:
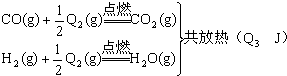
试回答下列问题:
(1)、判断两种途径放热:途径I放出的热量(填“大于”、“等于”、“小于”)途径II放出的热量.(2)、Q1、Q2、Q3的数学关系式是 .(3)、由于制取水煤气反应里,反应物所具有的总能量生成物所具有的总能量,那么在化学反应时,反应物应需要能量才能转化为生成物,因此其反应条件为 .(4)、简述煤通过途径II作为燃料的意义. .