浙江省温州市南浦实验中学2025-2026学年第一学期9月九年级科学学科素养反馈
试卷更新日期:2025-10-09 类型:月考试卷
一、选择题(本题有15小题,每题只有一个选项,每题2分,共30分)
-
1. 浙江拥有丰富的文化,以下是我省部分文化遗产,其制作过程主要属于化学变化的是( )A、嵊州竹编
 B、嘉善剪纸
B、嘉善剪纸 C、绍兴黄酒
C、绍兴黄酒 D、东阳木雕
D、东阳木雕 2. 下列用品的名称和有效成分对应错误的是( )
2. 下列用品的名称和有效成分对应错误的是( )A
B
C
D
用品
盐酸
熟石灰
食盐
烧碱
有效成分
HCl
Ca(OH)2
NaCl
Na2CO3
A、A B、B C、C D、D3. 下列基本实验操作正确的是 ( )A、检查气密性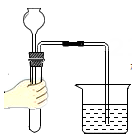 B、测量溶液 pH
B、测量溶液 pH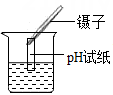 C、取固体药品
C、取固体药品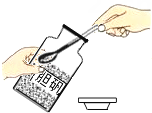 D、熄灭酒精灯
D、熄灭酒精灯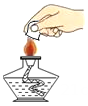 4. 生活中一些常见物质的pH如下:
4. 生活中一些常见物质的pH如下:物质
柠檬汁
西红柿
纯水
鸡蛋清
漂白液
pH
2~3
4~5
7
7~8
13~14
上述物质中,酸性最强的是( )
A、漂白液 B、西红柿 C、柠檬汁 D、鸡蛋清5. 合理使用氮肥、磷肥、钾肥是农业增产的重要手段,下列属于钾肥的是( )A、尿素 CO(NH2)2 B、硫酸钾 K2SO4 C、磷酸二氢铵 NH4H2PO4 D、硝酸铵 NH4NO36. 下列反应中,不属于复分解反应的是 ( )A、 B、 C、 D、NaCl+AgNO3=AgCl↓+NaNO37. 盐酸溶液和硫酸溶液具有相似的化学性质,其本质原因是( )A、都能与酸碱指示剂反应 B、都含有氢元素 C、都能电离出酸根阴离子 D、阳离子都只有氢离子8. 下列物质在空气中露置一段时间后,质量不会发生变化的是( )A、氢氧化钠 B、氯化钠 C、浓硫酸 D、浓盐酸9. 打开浓盐酸试剂瓶,发现瓶口有“白雾”出现.已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-)。下列实验可以证明“白雾”中含有氯离子的是( )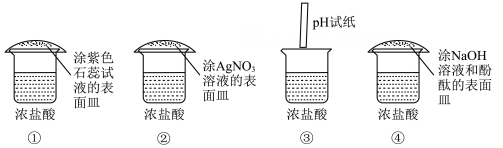 A、① B、② C、③ D、④10. 如图装置中,将胶头滴管中的液体滴在固体上,能使小气球鼓起来,则使用的固体和液体不能是( ).
A、① B、② C、③ D、④10. 如图装置中,将胶头滴管中的液体滴在固体上,能使小气球鼓起来,则使用的固体和液体不能是( ).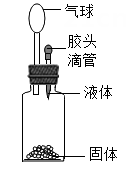
①铁和稀硫酸 ②碳酸钠和稀盐酸 ③氢氧化钠和水 ④硝酸铵和水
A、① B、② C、③ D、④11. 下列物质属于碱的是( )A、SO2 B、Na2CO3 C、Ba(OH)2 D、HCl12. 下列试剂中,能将稀盐酸、氯化钠、氢氧化钠三种溶液一步鉴别出来的是( )A、紫色石蕊溶液 B、氯化钡 C、酚酞 D、碳酸钠13. 在一定质量的氢氧化钠溶液中逐滴加入蒸馏水,如图中能正确表示溶液pH变化的是(横坐标表示加入蒸馏水的质量,纵坐标表示溶液的pH)( ).A、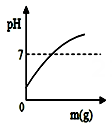 B、
B、 C、
C、 D、
D、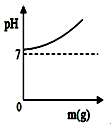 14. 想要去除氯化钠溶液中的氯化钙,可以适量加入以下哪种物质( )A、NaOH B、AgNO3 C、NaCl D、Na2CO315. 向某盐酸和氯化铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法不正确的是 ( ).
14. 想要去除氯化钠溶液中的氯化钙,可以适量加入以下哪种物质( )A、NaOH B、AgNO3 C、NaCl D、Na2CO315. 向某盐酸和氯化铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法不正确的是 ( ). A、a点溶液中滴入紫色石蕊试液变红 B、整个变化过程中氯离子数目没有改变 C、d点溶液中含有两种溶质 D、bc段反应的化学方程式为
A、a点溶液中滴入紫色石蕊试液变红 B、整个变化过程中氯离子数目没有改变 C、d点溶液中含有两种溶质 D、bc段反应的化学方程式为二、填空题(本题有7小题,每空2分,共32分)
-
16. 下列几种是常见的物质:a.盐酸 b.熟石灰 c.纯碱 d.食盐;
根据实际用途选择合适的标号(a~d)填空,①厨房中常见的调味品;②常用降低土壤酸性的是.
17. 用毛笔蘸取质量分数为 5%的稀硫酸在竹片上画花,然后把竹片放在小火上烘干,再用水洗净,在竹片上就得到黑色或褐色的花样,一幅精美的竹片画就制成了。 (1)、稀硫酸在烘干过程中成为浓硫酸,使富含纤维素的竹片呈现黑色或褐色,这利用了浓硫酸的性。(2)、图甲所示为浓硫酸稀释的正确操作图,图中试剂瓶所盛放的试剂是。18. 小塘分别向不同试剂中滴加了2滴自制紫薯汁,记录实验现象如表.请回答:
(1)、稀硫酸在烘干过程中成为浓硫酸,使富含纤维素的竹片呈现黑色或褐色,这利用了浓硫酸的性。(2)、图甲所示为浓硫酸稀释的正确操作图,图中试剂瓶所盛放的试剂是。18. 小塘分别向不同试剂中滴加了2滴自制紫薯汁,记录实验现象如表.请回答:试剂
稀盐酸
氢氧化钠溶液
蒸馏水
白醋
草木灰溶液
现象
红色
绿色
紫色
红色
绿色
(1)、在石灰水中滴加紫薯汁,溶液可能显示的颜色是。(2)、用pH试纸测定上述部分溶液的酸碱度,具体操作方法是:(3)、若用pH试纸测定草木灰溶液时,不慎将pH试纸用蒸馏水浸湿了,则测得的pH值应比真实值填“偏大”、“偏小”或“无影响”)。19. 构建知识网络,可以帮助我们理解知识间的内在联系。如图是盐酸与不同类别物质之间反应的知识网络。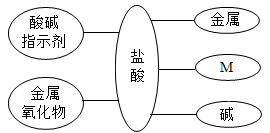 (1)、图中M应为类物质 (填物质类别)(2)、写出一种能与盐酸反应的金属氧化物20. 实验室存放石灰水的试剂瓶壁往往附有一层不溶于水的白色固体物质CaCO3 , 此现象的原因是(用化学方程式表示),可以用清洗。21. 如图1表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH 的变化曲线,请从曲线图中获取信息,回答下列问题:
(1)、图中M应为类物质 (填物质类别)(2)、写出一种能与盐酸反应的金属氧化物20. 实验室存放石灰水的试剂瓶壁往往附有一层不溶于水的白色固体物质CaCO3 , 此现象的原因是(用化学方程式表示),可以用清洗。21. 如图1表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH 的变化曲线,请从曲线图中获取信息,回答下列问题:
 (1)、根据图1判断,该实验是将滴加到另一种溶液中。(2)、实验结束时,老师滴加两滴反应后的溶液到玻璃片上,烘干后出现白色固体。小明说这是氢氧化钠,小刚认为不可能,证据是。(3)、图2是反应的微观变化图,对比反应前后的微粒,此反应的微观实质是。22. 现有一包白色粉末, 其中含有CuSO4、BaCl2、Na2CO3、Na2SO4中的一种或几种。某科学小组的同学为确定该白色粉末的成分,进行了如下实验:①取一定量白色粉末,加入足量水,振荡,得到无色透明溶液和白色沉淀;②向①中白色沉淀中滴加足量稀盐酸,观察到白色沉淀部分溶解,且有气泡产生。(1)、该白色粉末中一定没有的物质是。(2)、写出白色沉淀部分溶解的化学方程式:。
(1)、根据图1判断,该实验是将滴加到另一种溶液中。(2)、实验结束时,老师滴加两滴反应后的溶液到玻璃片上,烘干后出现白色固体。小明说这是氢氧化钠,小刚认为不可能,证据是。(3)、图2是反应的微观变化图,对比反应前后的微粒,此反应的微观实质是。22. 现有一包白色粉末, 其中含有CuSO4、BaCl2、Na2CO3、Na2SO4中的一种或几种。某科学小组的同学为确定该白色粉末的成分,进行了如下实验:①取一定量白色粉末,加入足量水,振荡,得到无色透明溶液和白色沉淀;②向①中白色沉淀中滴加足量稀盐酸,观察到白色沉淀部分溶解,且有气泡产生。(1)、该白色粉末中一定没有的物质是。(2)、写出白色沉淀部分溶解的化学方程式:。三、实验探究题(本题共3小题,23题(3)3分,其余每空2分,共21分)
-
23. 小科同学对实验室中已经变质的氢氧化钠固体进行探究。
【提出问题】氢氧化钠是否完全变质?
【猜想与假设】①部分变质,固体是 NaOH 和Na2CO3的混合物;
②全部变质,固体是
【查阅资料】NaCl溶液和 BaCl2溶液均呈中性
步骤
实验操作
实验现象
1
取少量固体于小烧杯中,加水充分溶解
固体全部溶解
2
取少量烧杯中的溶液于试管中,加入过量的 溶液
产生白色沉淀
3
取上层清液于另一试管中,再加入少量____溶液
产生红褐色絮状沉淀
(1)、【解释与结论】请将步骤3实验操作补充完整:。(2)、 步骤2 加入过量BaCl2溶液的目的是。(3)、根据实验现象,可确定该固体是NaOH 和Na2CO3的混合物。【交流与评价】小科同学把步骤3中的FeCl3溶液改为无色酚酞试液,若无色酚酞试液变红,也可以确定该固体是NaOH和 的混合物。你认为是否合理?并请说明理由。
24. 科学实践小组在学习酸和碱的反应后,从不同角度开展实验活动,验证酸和碱之间能发生反应。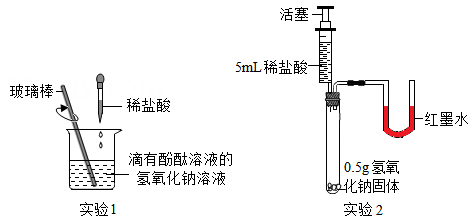
 (1)、通过溶液酸碱性的变化进行验证。
(1)、通过溶液酸碱性的变化进行验证。在实验1中,用滴管缓慢滴入稀盐酸,并不断搅拌。观察到现象时,证明了盐酸和 NaOH溶液发生了化学反应。
(2)、利用酸碱反应放热进行验证。在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氧氧化钠和盐酸发生了反应。但有的同学不赞同,他认为仍利用此装置,再补充一个实验才能达成实验2的目的。实验时,针筒内需要的试剂及用量为。
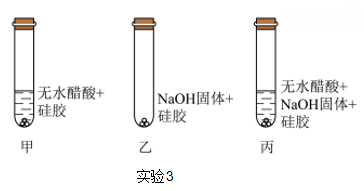
(3)、利用酸碱反应有水生成进行验证。实验3是醋酸与氢氧化钠固体进行的三个实验,其中硅胶具有吸水性,吸水后由蓝色变红色。若醋酸与氢氧化钠固体能反应,你能预测的实验现象是:。
25. 小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:某金属与同体积盐酸溶液反应实验数据盐酸溶液浓度
5%
1.0%
15%
6%
1.0%
16%
反应开始时酸溶液的温度(℃)
20
20
20
36
36
35
反应开始到2分钟产生的气体体积(mí)
10
19
28
28
72
103
反应结束共产生气体体积(mL,)
60
118
175
60
118
175
(1)、分析实验数据得出:一定质量的某种金属和同体积盐酸反应,影响金属和酸反应快慢的主要因素、。(2)、实验通过比较数据来确定金属和酸反应的快慢。(3)、过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。可能的原因是。四、 解答题(本题共3小题, 26题6分, 27题3分, 28题8分, 共17分)
-
26. 硝酸钾(KNO3)是一种优质复合肥,具有氮养分吸收快、肥料利用率高、作物品质好等特点。长期使用,能自动调解土壤、水分、空气、肥料四者关系。(1)、硝酸钾的相对分子质量是。(2)、硝酸钾中氮元素与氧元素的质量比为。(3)、101克硝酸钾中含氮元素克。27. 某石化厂的一种石油产品中,残余硫酸的质量分数为4.9%,工作人员用NaOH溶液来清洗残留的硫酸。请计算:若要清洗100千克的这种石油产品,需要多少千克的NaOH?(化学方程式为:28. 小科用过量的稀盐酸和石灰石反应制取二氧化碳,得到了含有盐酸和氯化钙的混合溶液。为了探究混合溶液中氯化钙的质量分数,小科进行了如下实验:取100克混合溶液于烧杯中,然后将240g碳酸钠溶液分六次加入其中,每次充分反应后称量相关质量,所测数据如下表。(化学方程式为:2H )
实验次数
第1次
第2次
第3次
第4次
第5次
第6次
加入碳酸钠溶液的质量/g
40
40
40
40
40
40
每次产生气体的质量/g
4.4
4.4
2.2
0
0
0
每次产生沉淀的质量/g
0
0
5
m
10
0
请根据实验数据分析解答下列问题:
(1)、 m的数值为。(2)、求混合溶液中氯化钙的质量分数。(3)、如图甲表示原混合溶液中的离子种类和数量,请在图乙中画出第3次加入碳酸钠溶液充分反应后的相关离子数量柱状图。