浙江省嘉兴市嘉兴南湖实验学校2025-2026学年九年级上9月科学素养作业
试卷更新日期:2025-10-09 类型:月考试卷
一、选择题(每小题3分,共36分)
-
1. 如图是浙江非物质文化遗产的代表,它们在制作过程中主要利用化学变化的是( )A、
 竹编
B、
竹编
B、 石雕
C、
石雕
C、 酿酒
D、
酿酒
D、 刺绣
2. 小明在碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液。该实验过程的操作如图所示,下列有关操作与目的分析均正确的是( )
刺绣
2. 小明在碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液。该实验过程的操作如图所示,下列有关操作与目的分析均正确的是( )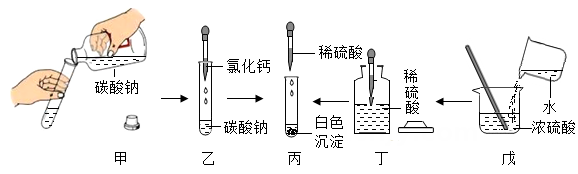 A、甲中试剂瓶标签正对手心,是为了防止手被腐蚀 B、乙中将滴管伸入试管内,是为了防止试剂滴落到试管外 C、丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染 D、戊中将水缓缓倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅3. 肉类的鲜度可以通过测试PH来判断。有资料显示,PH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )
A、甲中试剂瓶标签正对手心,是为了防止手被腐蚀 B、乙中将滴管伸入试管内,是为了防止试剂滴落到试管外 C、丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染 D、戊中将水缓缓倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅3. 肉类的鲜度可以通过测试PH来判断。有资料显示,PH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )名称
新鲜肉
次鲜肉
变质肉
PH
5.8~6.2
6.3~6.6
>6.6
A、变强 B、变弱 C、不变 D、无法确定4. 下列物质的名称、俗称、化学式不能表示同一物质的是 ( )A、氢氧化钠、纯碱、NaOH B、二氧化碳、干冰、CO2 C、氢氧化钙、消石灰、 D、氧化钙、生石灰、CaO5. 小明为了庄稼生长茂盛,茎杆粗壮,增强抗病虫害能力,需要施肥,下列物质属于钾肥的是( )A、 B、 C、K2CO3 D、6. 下列是忘记盖瓶塞的氢氧化钠溶液是否变质的检验,在取少量溶液样品进行的相关实验中,实验现象及结论不合理的是(已知BaCl2溶液和CaCl2溶液均呈中性)( ).A、滴入足量的澄清石灰水,有白色沉淀生成,滤液的 pH>7,证明原样品部分变质 B、滴入足量的氯化钡溶液、有白色沉淀生成,滤液的 pH>7,证明原样品部分变质 C、滴入足量稀盐酸,没有明显现象,证明原样品没有变质 D、滴入足量氯化钡溶液,有白色沉淀生成,滤液的pH=7,证明原样品全部变质7. 氢氧化钴[Co(OH)2]可作为涂料和清漆的干燥剂,其可以通过如下的化学反应制备:该反应属于( ).A、化合反应 B、分解反应 C、置换反应 D、复分解反应8. 下列选项中各种溶质的溶液混合,无明显现象的是 ( ),A、NaOH、NH4Cl、Fe2(SO4)3 B、KNO3、AgNO3、NaCl· C、KCl、CH3COOH、Na2CO3 D、9. 现有盐酸和氯化铜的混合溶液,向其中逐滴滴入氢氧化钠溶液,生成沉淀质量与滴入氢氧化钠溶液质量的变化关系如图所示。以下说法正确的是( )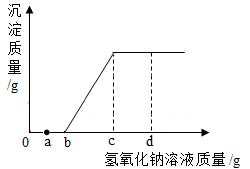
①滴加氢氧化钠溶液的质量至 ag时,溶液中含有两种溶质
②滴加氢氧化钠溶液的质量为m(),此时溶液中发生的化学反应为
③滴加氢氧化钠溶液的质量至 dg时,溶液 pH>7
④在滴加氢氧化钠溶液的整个过程中,溶液中氯元素的质量先减小后不变
A、②③ B、①②③ C、③④ D、②③④10. 向一定量的氢氧化钠溶液中逐滴加入pH=2的稀盐酸至过量.下列图象中,能正确反映对应变化关系的是( )A、 B、
B、 C、
C、 D、
D、 11. 下列实验操作不能达到实验目的的是 ( )
11. 下列实验操作不能达到实验目的的是 ( )选项
实验目的
实验操作
A
除去氯化钠溶液中少量的氯化钙
加适量的碳酸钠溶液,过滤
B
检验氢氧化钠样品是否变质
取样,加水溶解,滴加足量稀盐酸
C
鉴别氯化钾溶液和氯化钡溶液
取样,滴加稀硫酸溶液
D
分离CaCl2、NaCl混合溶液
通入 过滤、洗涤,向滤渣中滴加适量稀盐酸
A、A B、B C、C D、D12. 向氢氧化钡溶液中逐滴加入稀硫酸,某个量y随稀硫酸加入的变化情况如图所示,则y可以表示 A、沉淀的质量 B、氢氧化钡的质量 C、溶液的pH D、溶质的质量
A、沉淀的质量 B、氢氧化钡的质量 C、溶液的pH D、溶质的质量二、填空题(本大题共有6题,每小空2分,共30分)
-
13. 用符合下列要求的物质的序号填空:
①稀硫酸 ②浓盐酸 ③浓硫酸 ④烧碱 ⑤熟石灰
(1)、具有挥发性的是。(2)、可用于干燥二氧化碳气体的是。(3)、可用于改良酸性土壤的是。14. 检验溶液的酸碱性可以使用 , 测定物质酸碱性强弱最常用、最简单的方法是使用。15. 在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质,如图所示,即氢氧化钙与图中四类物质能够发生化学反应。 (1)、为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成色。(2)、利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量氢氧化钙杂质,请写出该化学反应的方程式:。16. 测定某Na2CO3和NaCl固体混合物中NaCl的质量分数,小夏设计了两个方案进行实验,分别取 mg样品。
(1)、为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成色。(2)、利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量氢氧化钙杂质,请写出该化学反应的方程式:。16. 测定某Na2CO3和NaCl固体混合物中NaCl的质量分数,小夏设计了两个方案进行实验,分别取 mg样品。方案一:与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体.
方案二:与足量浓盐酸充分反应,逸出的气体用NaOH固体充分吸收,固体质量增加m2g,你认为方案合理,写出你选择方案中相关的化学方程式 , 并说明你做出选择的理由。17. 在CuSO4溶液中加入足量的NaOH溶液至反应完全,反应的微观模型如图所示。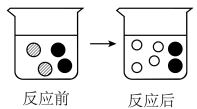 (1)、该反应的实验现象为 , 其基本反应类型为。(2)、如图的“
(1)、该反应的实验现象为 , 其基本反应类型为。(2)、如图的“ ”“
”“ ”“
”“ ”表示溶液中由溶质电离产生的不同离子,则反应前“●”表示。(填写离子符号) 18. 某兴趣小组同学进行如图甲所示的实验。实验结束后,他们把①、②两支试管中的物质倒入乙图所示的烧杯中,充分混合后观察到有红褐色絮状沉淀生成,溶液呈黄色。
”表示溶液中由溶质电离产生的不同离子,则反应前“●”表示。(填写离子符号) 18. 某兴趣小组同学进行如图甲所示的实验。实验结束后,他们把①、②两支试管中的物质倒入乙图所示的烧杯中,充分混合后观察到有红褐色絮状沉淀生成,溶液呈黄色。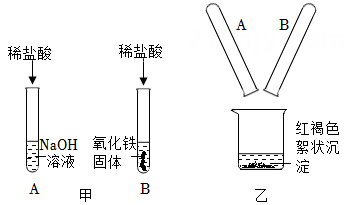 (1)、图甲中,试管①中物质充分反应后,有剩余的反应物为。(2)、通过以上现象,能确定烧杯内溶液中含有的溶质是。
(1)、图甲中,试管①中物质充分反应后,有剩余的反应物为。(2)、通过以上现象,能确定烧杯内溶液中含有的溶质是。三、实验探究题(每小空2分,共18分)
-
19. 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验如图。请你与他们一起完成以下探究活动:
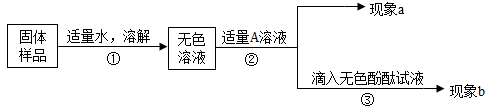
查阅资料:Na2CO3溶液的pH>7,与盐酸反应有气泡产生,与 Ca(OH)2溶液反应有白色沉淀生成。
对固体猜想:
猜想Ⅰ: 全部是 NaOH; 猜想Ⅱ: 全部是 Na2CO3;
猜想Ⅲ: 是NaOH和Na2CO3混合物。
实验和推断:
(1)、若现象a为有气泡产生,则加入的A溶液是 , 说明氢氧化钠已经变质。(2)、若A是 Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色(填“能”或“不能”)说明样品中有 NaOH。(3)、若A是CaCl2溶液,当实验现象a和b分别为 , 则猜想Ⅱ成立。20. 如图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。 (1)、若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到 ,(2)、若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。下表为所用的试剂。
(1)、若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到 ,(2)、若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。下表为所用的试剂。滴管甲
烧杯①
滴管乙
烧杯②
试剂
H2O
NaOH固
体
稀盐酸
Na2CO3
请分析气球前后两次变化的原因
21. 实验室中有一种含有纯碱、小苏打和少量水的固体粉末样品。为了测定其中小苏打的含量,某化学兴趣小组的同学在老师的指导下,利用如图所示装置(部分固定装置已略去)进行实验。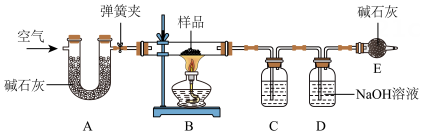
已知:①该装置气密性良好,A. C. D中所装药品足量且能完全吸收相关物质.
②碱石灰是CaO与NaOH 的固体混合物
③加热条件下,纯碱稳定不分解,小苏打易分解,反应的化学方程式为:
探究过程如下:
Ⅰ.称量样品和已装入相关药品的装置C. D的质量,分别为:m、m1、m2;Ⅱ.将质量为m的样品装入B玻璃管中,按图连接好装置,关闭弹簧夹,给玻璃管加热
Ⅲ.待玻璃管中样品完全反应,打开弹簧夹通空气,再熄灭酒精灯,直到玻璃管冷却
Ⅳ.再次称量装置C. D的质量,分别为m3、m4
请回答下列问题
(1)、装置C中所装药品为。(2)、装置D中发生反应的化学方程式为。(3)、装置E的作用。(4)、依据实验所得数据计算,该样品中小苏打的质量分数为(用相关字母表示)。四、综合题(共16分)
-
22. 10克碳酸钙与稀盐酸反应,加入稀盐酸的质量与生成气体的质量关系如图所示。
 (1)、当加入73克稀盐酸时,稀盐酸与碳酸钙恰好完全反应。求:所加稀盐酸的溶质质量分数是多少?(2)、当加入120克稀盐酸后,经充分反应,溶液中的溶质是。23. 向氧化铜中加入一定量的稀硫酸,充分反应后得到溶液。为了测定该溶液的成分,小明取50克所得溶液于烧杯中逐滴滴入溶质质量分数为16%的NaOH溶液,产生沉淀的质量如表所示。请根据题意回答下列问题:
(1)、当加入73克稀盐酸时,稀盐酸与碳酸钙恰好完全反应。求:所加稀盐酸的溶质质量分数是多少?(2)、当加入120克稀盐酸后,经充分反应,溶液中的溶质是。23. 向氧化铜中加入一定量的稀硫酸,充分反应后得到溶液。为了测定该溶液的成分,小明取50克所得溶液于烧杯中逐滴滴入溶质质量分数为16%的NaOH溶液,产生沉淀的质量如表所示。请根据题意回答下列问题:氢氧化钠溶液质量(克)
20
40
60
80
100
120
沉淀质量(克)
0
0
1.96
5.88
a
9.8
(1)、表格中“a”的值为。(2)、分析表格中的数据可知:被测溶液中的溶质成分是。(3)、当氢氧化钠溶液加至恰好完全反应时,所得溶液的质量是克。(4)、计算50克溶液中硫酸铜的质量。(写出计算过程)