人教版(五四学制)初中化学八年级全一册单元测试 第五单元 化学方程式(提升卷)
试卷更新日期:2025-09-28 类型:单元试卷
一、选择题
-
1. 某化合物与9.6g氧气在点燃的条件下恰好完全反应,生成8.8g二氧化碳和5.4g水,则该化合物的化学式为A、CH3OH B、C2H5OH C、CH4 D、C2H62. 甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是
 A、参加反应的甲和乙质量比为2:7 B、丙可能是该反应的催化剂 C、丁一定是化合物 D、x的值是73. 下列方程式书写正确的是A、 B、 C、 D、4. 汽车开动和人的生命活动都需要能量。给汽车开动和人的生命活动提供能量的两个过程如图所示,下列分析错误的是
A、参加反应的甲和乙质量比为2:7 B、丙可能是该反应的催化剂 C、丁一定是化合物 D、x的值是73. 下列方程式书写正确的是A、 B、 C、 D、4. 汽车开动和人的生命活动都需要能量。给汽车开动和人的生命活动提供能量的两个过程如图所示,下列分析错误的是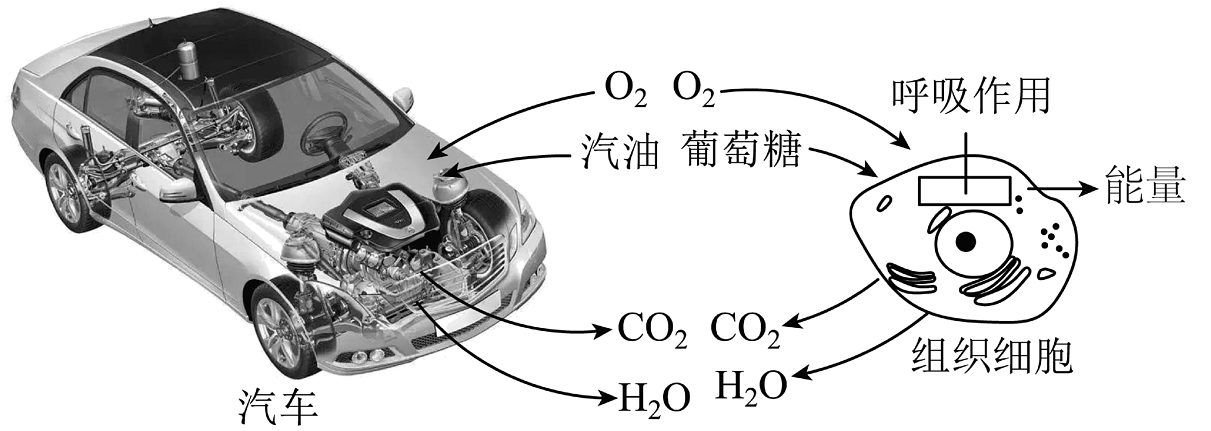 A、都通过剧烈的氧化反应释放出能量 B、都将化学能转化为其他形式的能 C、都参与自然界的氧循环 D、都遵循能量的转化和质量守恒定律5. 下列叙述完全符合质量守恒定律的是A、水结成冰前后,质量保持不变 B、50mL水和50mL乙醇混合后总体积小于100mL C、在100g过氧化氢溶液中,含有30g过氧化氢和70g水 D、1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳6. 形成化学观念是化学学习的任务之一。下列有关叙述中。不正确的是A、微粒观:一氧化碳和二氧化碳化学性质不同,是因为它们的分子构成不同 B、守恒观:12g碳和16g氧气充分反应,生成28g二氧化碳 C、元素观:某物质在氧气中燃烧有水生成,证明该物质中含有氢元素 D、能量观:化学反应在生成新物质的同时,还会伴随着能量变化7. 在反应中,和足量在一定条件下充分反应生成 , 已知的相对分子质量为32,则A的相对分子质量是A、26 B、28 C、30 D、328. 在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应后各物质的质量如下,下列说法不正确的是
A、都通过剧烈的氧化反应释放出能量 B、都将化学能转化为其他形式的能 C、都参与自然界的氧循环 D、都遵循能量的转化和质量守恒定律5. 下列叙述完全符合质量守恒定律的是A、水结成冰前后,质量保持不变 B、50mL水和50mL乙醇混合后总体积小于100mL C、在100g过氧化氢溶液中,含有30g过氧化氢和70g水 D、1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳6. 形成化学观念是化学学习的任务之一。下列有关叙述中。不正确的是A、微粒观:一氧化碳和二氧化碳化学性质不同,是因为它们的分子构成不同 B、守恒观:12g碳和16g氧气充分反应,生成28g二氧化碳 C、元素观:某物质在氧气中燃烧有水生成,证明该物质中含有氢元素 D、能量观:化学反应在生成新物质的同时,还会伴随着能量变化7. 在反应中,和足量在一定条件下充分反应生成 , 已知的相对分子质量为32,则A的相对分子质量是A、26 B、28 C、30 D、328. 在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应后各物质的质量如下,下列说法不正确的是A
B
C
D
反应前的质量/g
55
2
1
5
反应后的质量/g
待测
12
7
9
A、A一定是化合物 B、化学反应中C与D的质量比为7:9 C、反应后测得A的质量为35g D、上述反应属于分解反应9. 形成化学观念是化学学习的任务之一,下列有关叙述中,不正确的是A、微粒观:2个水分子在通电的条件下生成1个氧分子和2个氢分子 B、守恒观:碳和氧气充分反应,生成二氧化碳 C、元素观:过氧化氢和水都是由氢元素和氧元素组成的 D、能量观:化学反应在生成新物质的同时,还伴随着能量的变化10. 镁在氧气中燃烧,生成氧化镁,在这个反应中,镁、氧气、氧化镁三者的质量比是A、6∶4∶11 B、13∶8∶20 C、24∶32∶40 D、48∶32∶8011. 下列现象能用质量守恒定律解释的是A、“卫生球”放在衣柜里,质量减少 B、将氯化钠固体放入水中完全溶解后得溶液 C、蜡烛完全燃烧后,生成水和二氧化碳的质量之和等于蜡烛质量 D、纸在密闭容器中充分燃烧后化为灰烬,反应前后总质量不变12. 下列化学方程式书写完全正确的是A、C+O2CO2↑ B、HgOHg+O2↑ C、2NaOH+H2SO4=Na2SO4+2H2O D、CuSO4+2NaOH=Na2SO4+Cu(OH)213. 在A+3B=2C+2D的反应中,14gA完全反应生成44gC和18gD,若B的相对分子质量为32,则A的相对分子质量是A、14 B、28 C、42 D、5614. 在化学反应A+2B=C+D中,已知16gA和20gB恰好完全反应,生成C和D的质量比为7∶2,则生成C的质量为A、8g B、28g C、36g D、16g15. 在光照条件下,可分解为和某种氮的氧化物X,取一定质量的固体充分光照,测得反应后生成的质量分别为21.6g、mg、9.2g。下列说法不正确的是A、的质量为 B、该反应方程式中与的化学计量数之比为 C、X的化学式为 D、固体应保存在能避光的棕色广口瓶中二、填空题
-
16. 建知识网络是学习化学的重要方法。如图是小明同学绘制的表示氧气制取和化学性质的部分网络图,A、B、C分别表示初中化学常见的物质,B由铁丝在氧气中燃烧生成。
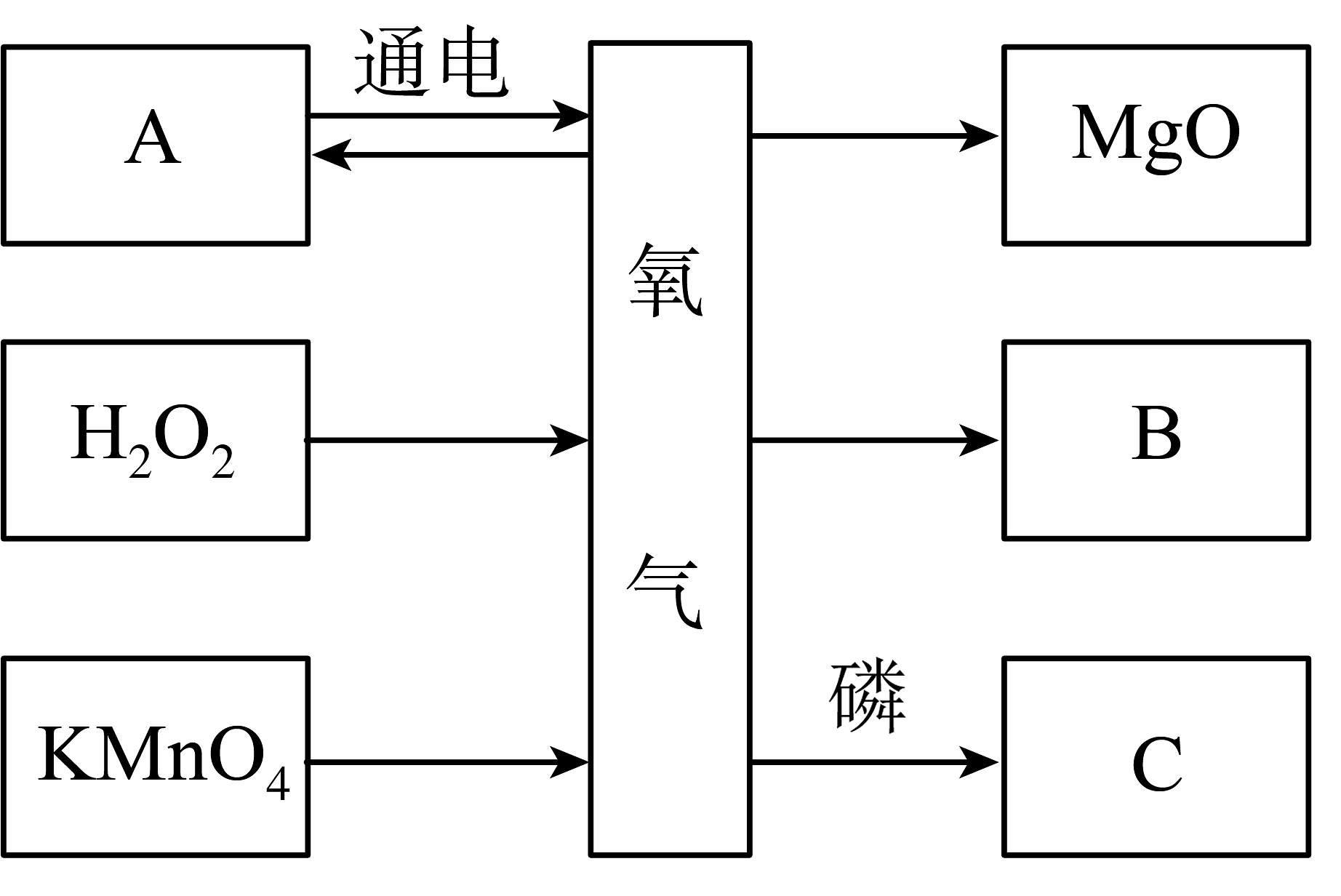
试结合图示回答:
(1)、写出物质的化学式:A , C。(2)、A物质、H2O2、KMnO4都可以制得氧气,是因为这三种物质中都含有 , 有氧气参加的三个化学反应的相同点是(请写出一点)。(3)、写出上图中生成B的化学方程式。(4)、请从微观角度分析木炭在氧气中燃烧比在空气中更剧烈的原因是。17. 回答下列问题。 (1)、图中仪器a的名称是。(2)、实验室用高锰酸钾制取O2及性质检验。
(1)、图中仪器a的名称是。(2)、实验室用高锰酸钾制取O2及性质检验。①反应的化学方程式为。
②应选择图中的发生装置(填字母)。
③收集一瓶O2并进行如图C实验。铁丝在氧气中燃烧时,可观察到的现象为剧烈燃烧,火星四射,放出大量的热,。
④集气瓶中水的作用是。
(3)、制作氧自救呼吸器查阅资料:超氧化钾(KO2)为黄色固体,分别与CO2、H2O反应生成O2和白色固体、产氧效率高,适合作生氧剂。
原理分析:①4KO2+2CO2=2K2CO3+3O2、4KO2+2H2O=4X+3O2↑则X的化学式为。
动手实践:②设计并制作氧自救呼吸器,如图D所示,使用一段时间后,观察到生氧剂由(填颜色变化),则基本失效。
18. 硫酸是一种重要的化工原料,下图展示了工业上用黄铁矿石(主要成分是FeS2)炼铁过程中将间接得到的一种空气污染物“变废为宝”转化为硫酸产品消除污染,增加效益的工艺流程。请回答下列问题: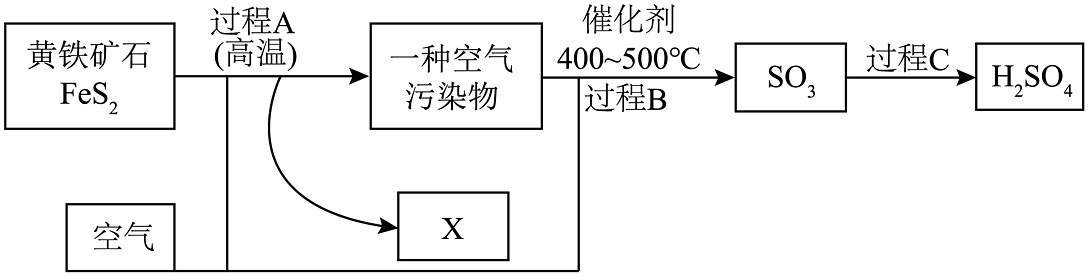 (1)、过程A中发生的化学反应方程式是4FeS2+11O22X+8SO2 , 则X的化学式是。(2)、请写出过程A反应结束时得到的空气污染物中硫元素的化合价。(3)、过程C是属于化合反应的基本类型,其中有一种液态反应物被隐藏了,请根据所学知识猜测过程C所发生的化学反应方程式:。19. 请沿用科学家认识事物的方式认识“空气”,并完成下列问题(1)、分类角度,下列关于空气的说法正确的是 。A、空气是由空气分子构成 B、N2、O2等均匀地混合 C、N2、O2不再保持各自的化学性质(2)、微观角度,用“
(1)、过程A中发生的化学反应方程式是4FeS2+11O22X+8SO2 , 则X的化学式是。(2)、请写出过程A反应结束时得到的空气污染物中硫元素的化合价。(3)、过程C是属于化合反应的基本类型,其中有一种液态反应物被隐藏了,请根据所学知识猜测过程C所发生的化学反应方程式:。19. 请沿用科学家认识事物的方式认识“空气”,并完成下列问题(1)、分类角度,下列关于空气的说法正确的是 。A、空气是由空气分子构成 B、N2、O2等均匀地混合 C、N2、O2不再保持各自的化学性质(2)、微观角度,用“ ”表示氮原子,“
”表示氮原子,“ ”表示氧原子。
”表示氧原子。①用“
 ”可表示的微粒是 (填名称)。
”可表示的微粒是 (填名称)。②同温同压下,气体的体积比等于分子个数比,若空气中其它成分忽略不计,如图可表示空气微观模型的是。
A.
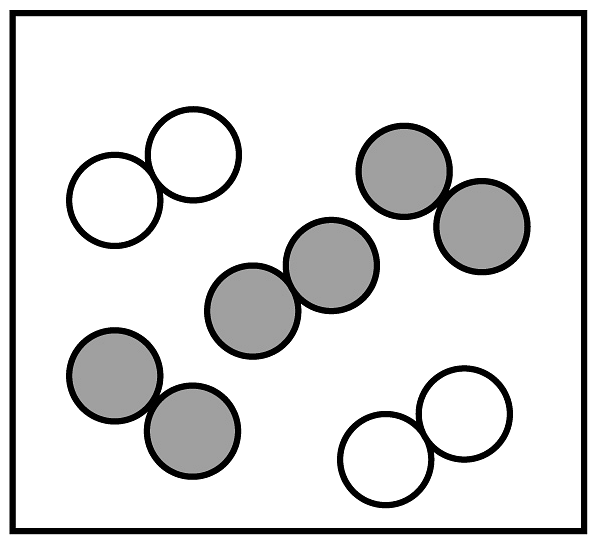 B.
B. 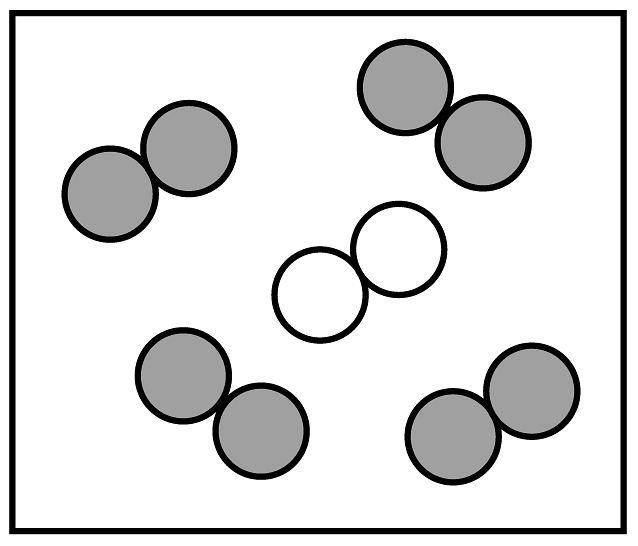 C.
C.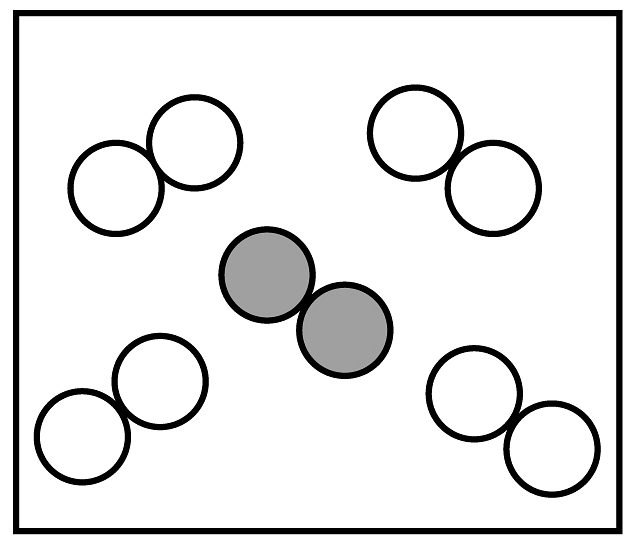 (3)、变化角度
(3)、变化角度①常压下,氮气沸点-196℃,氧气沸点-183℃,将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是。
②下列叙述正确的是。
A.木炭在空气中燃烧,发出白光
B.铁丝在空气中燃烧,剧烈燃烧,火星四射,生成黑色固体
C.夏天从冰箱里拿出冰棍周围有白雾,是空气中的水蒸气液化
D.久盛石灰水的试剂瓶内壁有一层白膜,证明空气中有二氧化碳
(4)、应用角度①氢气可用作火箭的燃料,其燃烧的化学方程式为 。
②薯片等易碎食品宜采用充气包装,下列气体中最适宜充入的是。
A.O2 B.N2 C.H2 D.空气
(5)、环保角度①下列物质属于空气污染物的是。
A.SO2 B.CO C.NO2 D.CO2
②下列保护空气措施合理的是。
A.工厂通过加高烟囱直接排放废气
B.城市推广使用氢燃料电池客车
C.提倡步行、骑自行车等“低碳”出行方式
D.禁止使用煤、石油、天然气等化石燃料)
③汽车尾气中 NO 与 CO 在催化剂的作用下,反应生成 CO2和一种无污染的空气中含量最多的单质气体。写出该反应的化学方程式:。
20. 在实验室可以通过加热高锰酸钾(KMnO4)来制取氧气,该反应的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑。某兴趣小组对一定质量的高锰酸钾加热一段时间,并称量不同时刻剩余固体质量,记录数据如表:时间
0
t1
t2
t3
t4
质量(g)
31.6
31.3
30.8
30.1
29.2
(1)、已知高锰酸钾和锰酸钾(K2MnO4)都易溶于水,实验结束后回收二氧化锰固体的方法为:。(2)、若加热至t4时刻就停止实验,理论上可以回收到多少二氧化锰?(写出详细计算过程)