人教版(五四学制)初中化学八年级全一册单元测试-第五单元 化学方程式(基础卷)
试卷更新日期:2025-09-27 类型:单元试卷
一、选择题
-
1. 浓硝酸(硝酸化学式为HNO3)要保存在棕色瓶内,因为浓硝酸见光易发生分解反应。下列物质中,不是浓硝酸分解产物的是A、O2 B、H2O C、HCl D、NO22. 逻辑推理是一种重要的化学思维方法,以下推理合理的是A、一氧化碳和二氧化碳的组成元素相同,所以两者的化学性质相同 B、因为和的组成中都含有氢元素,所以它们的燃烧产物中都含有水 C、因为化学变化都遵循质量守恒定律,所以质量不发生改变的变化一定是化学变化 D、因为单质都是由同种元素组成的,所以同种元素组成的物质一定是单质3. 某物质完全燃烧生成二氧化碳和水。则对该物质判断正确的是A、该物质只含碳、氢元素 B、该反应中和的分子数之比为1:2 C、该反应中和的质量比为12:11 D、该物质分子中碳原子和氢原子的个数比为1:24. 奥司他韦(分子式:)可用于甲型和乙型流感病毒的预防和治疗,能够抑制流感病毒的活性,达到清除病毒的治疗效果。下列有关奥司他韦说法正确的是A、碳元素的质量分数最大 B、奥司他韦由16个碳原子、28个氢原子、2个氮原子和4个氧原子构成 C、完全燃烧的产物只有二氧化碳和水 D、相对分子质量是5. 铜能与浓硫酸反应,但不产生氢气。根据反应方程式 , 推测的化学式为A、 B、 C、 D、6. 2022年4月29日《科技日报》报道“我国科学家实现CO2到葡萄糖和油脂的人工合成”,合成过程中的一个重要反应微观示意图如下,下列有关说法正确的是
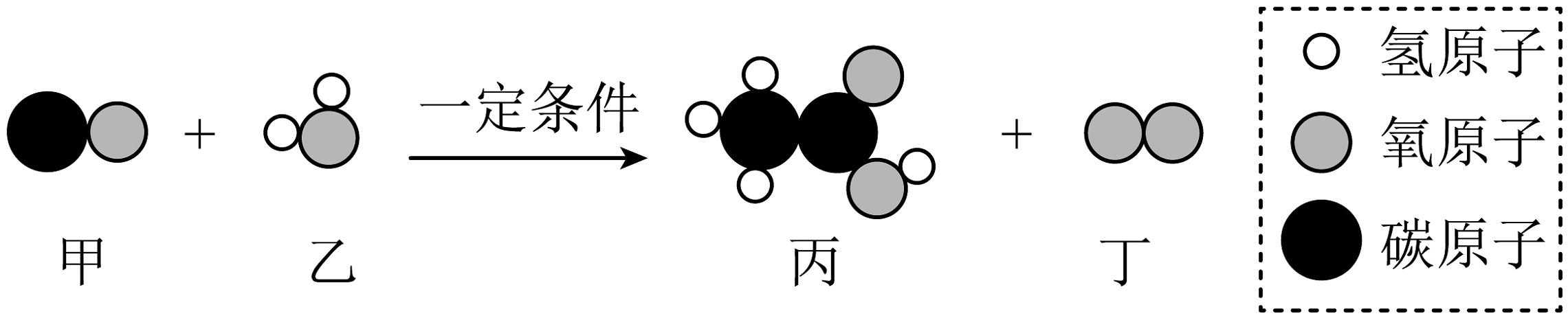 A、反应前后分子的个数不变 B、该反应前后共涉及两种氧化物 C、丙物质由8个原子构成 D、参加反应的甲和生成丁的质量比是7:87. 我国古代将炉甘石(ZnCO3)、赤铜和木炭粉混合后加热到约800℃,有如下反应发生:
A、反应前后分子的个数不变 B、该反应前后共涉及两种氧化物 C、丙物质由8个原子构成 D、参加反应的甲和生成丁的质量比是7:87. 我国古代将炉甘石(ZnCO3)、赤铜和木炭粉混合后加热到约800℃,有如下反应发生:①ZnCO3ZnO+CO2↑②C+2ZnO2Zn+X↑。下列有关说法错误的
A、“X”的化学式为CO2 B、反应前后锌元素质量不变 C、①基本反应类型为分解反应 D、②反应前后锌元素化合价升高8. 如表图像能正确反映对应变化关系的是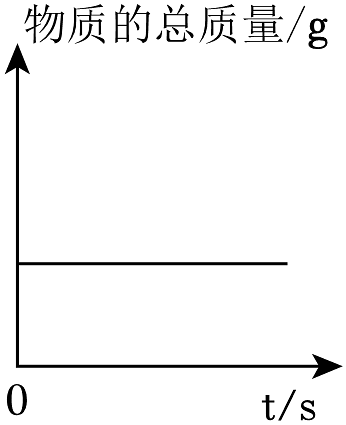
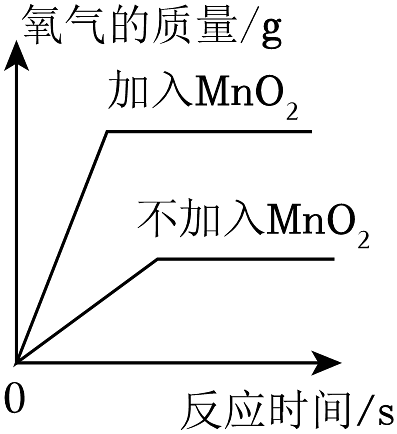
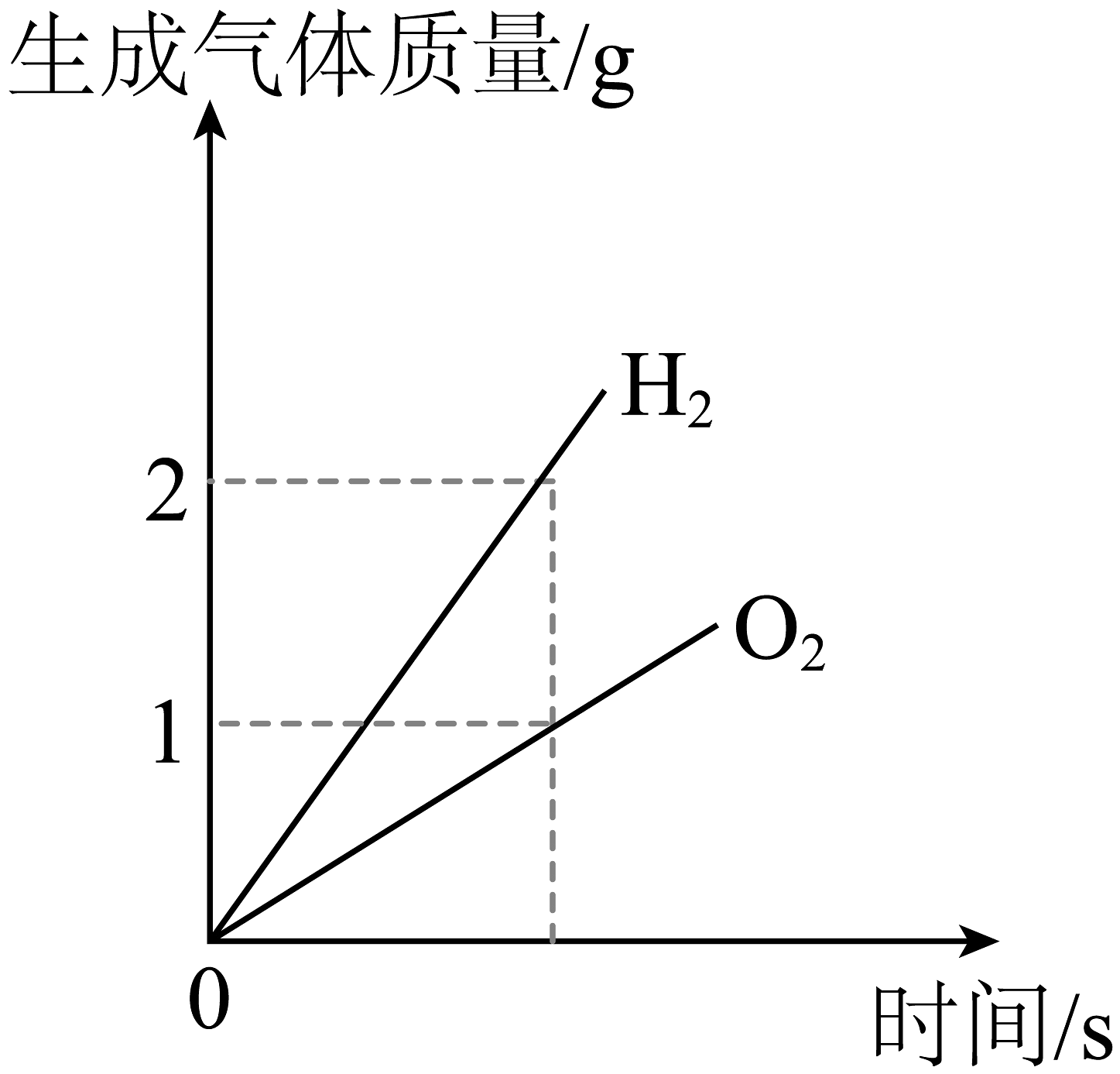
A.镁条在密闭容器中燃烧
B.两份完全相同的过氧化氢溶液在有、无MnO2的情况下产生O2
C.在密闭容器中点燃红磷
D.水通电分解
A、A B、B C、C D、D9. 下列四个图像中,能正确反映对应变化关系的是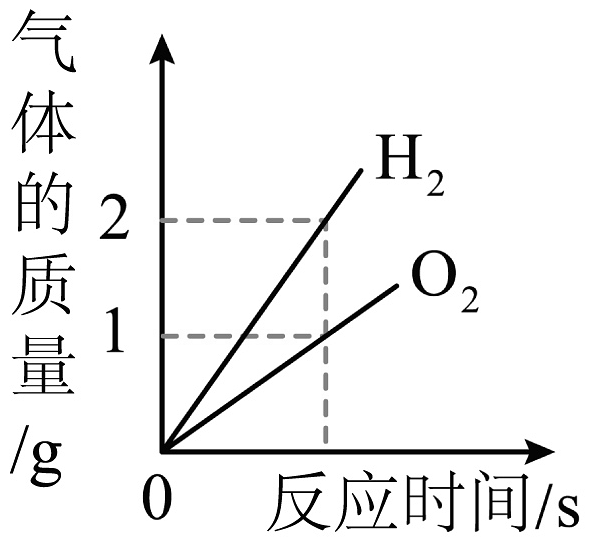
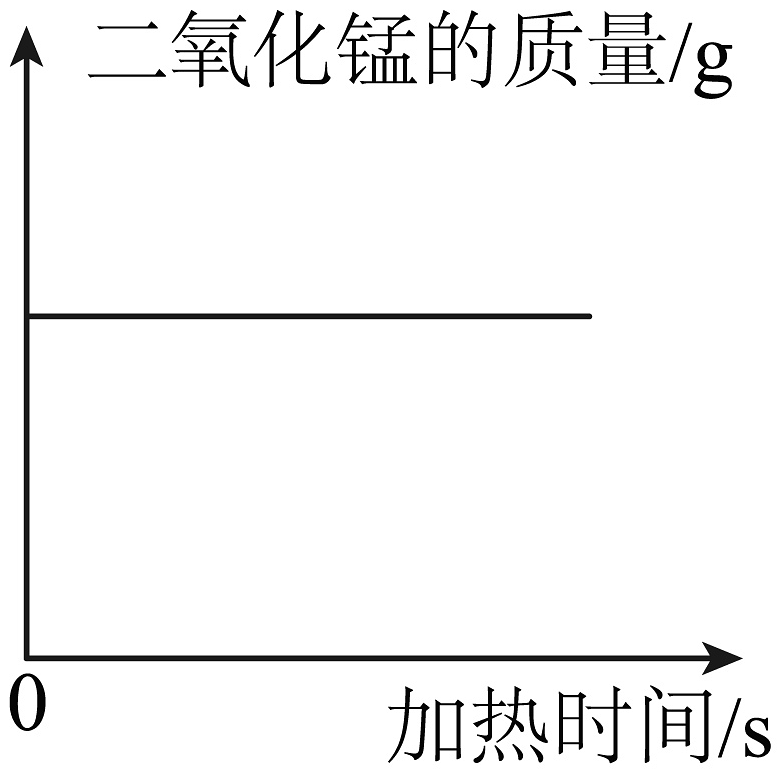
A.用做催化剂,光分解水制氢气与氧气
B.氯酸钾中加入少量二氧化锰充分加热
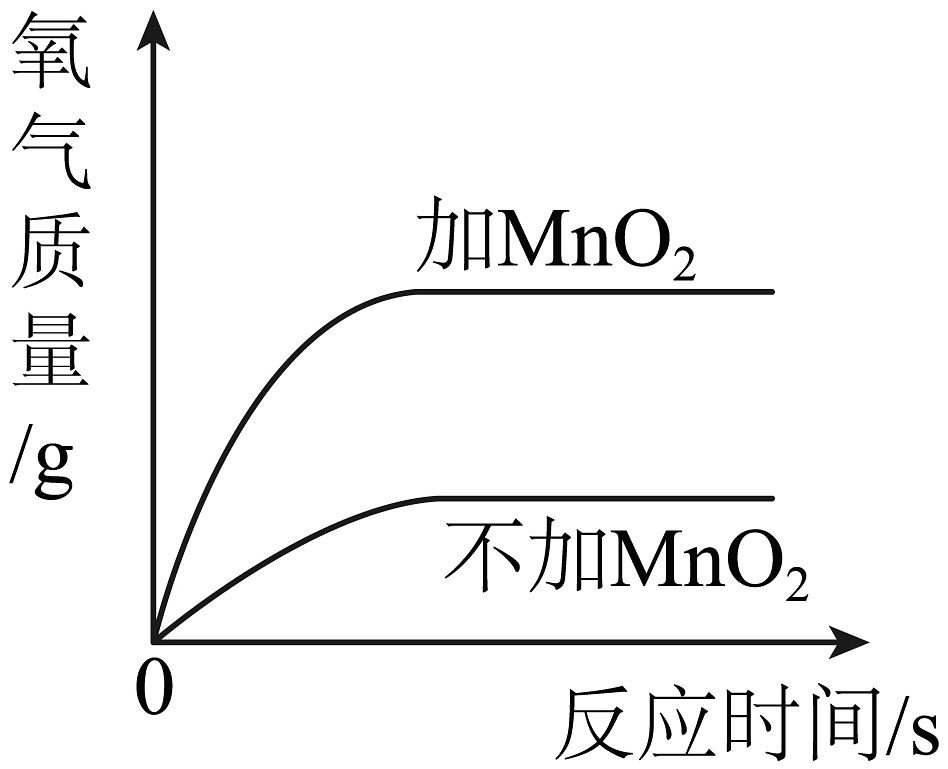

C.两份等体积的过氧化氢溶液,向其中一份加入少量二氧化锰
D.加热一定质量的高锰酸钾固体
A、A B、B C、C D、D10. 下列涉及化学学科观念的说法正确的是A、转化观:冰融化为水是化学变化 B、微粒观:二氧化碳是由1个碳原子和2个氧原子构成的 C、守恒观:红磷和氧气反应,生成五氧化二磷 D、结构观:构成水和过氧化氢的分子结构不同,两种化合物的化学性质也不同11. 甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( ) A、x的值是19 B、丙可能是该反应的催化剂 C、丁一定是化合物 D、参加反应的甲和乙质量比为12∶1912. 密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法正确的是
A、x的值是19 B、丙可能是该反应的催化剂 C、丁一定是化合物 D、参加反应的甲和乙质量比为12∶1912. 密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法正确的是 A、该化学反应是化合反应 B、反应后乙物质的质量分数是 C、参加反应的甲与丙的质量比为 D、物质丁一定是该反应的催化剂13. 氢氟酸与玻璃发生反应的化学方程式为 , 则X的化学式是A、F2 B、O2 C、SiH4 D、SiF414. 密闭容器中装有W、X、Y、Z四种物质,高温反应前后质量变化如下,下列选项错误的是
A、该化学反应是化合反应 B、反应后乙物质的质量分数是 C、参加反应的甲与丙的质量比为 D、物质丁一定是该反应的催化剂13. 氢氟酸与玻璃发生反应的化学方程式为 , 则X的化学式是A、F2 B、O2 C、SiH4 D、SiF414. 密闭容器中装有W、X、Y、Z四种物质,高温反应前后质量变化如下,下列选项错误的是物质
W
X
Y
Z
反应前质量/g
2
10
1
30
反应后质量/g
30
4
m
8
A、m的值为1 B、该反应的基本类型是化合反应 C、Y可能是反应中的催化剂 D、参加反应的X与Z的质量比是1∶215. 二氧化氯(ClO2)可用于自来水消毒,它具有显著的杀菌能力。制取ClO2的化学方程式为: , 则X的化学式为( )A、NaClO3 B、NaClO C、HClO3 D、Na2CO3二、非选择题
-
16. “神舟17号”载人航天飞船发射圆满成功,承载着中华民族百年飞天梦更进一步!(1)、航天员头盔面窗两层之间充有高纯氮气,工业上可利用氮气和氧气的不同分离出氮气。(2)、空间站内氧气的主要来源是电解水,电解水的化学方程式是。(3)、呼出的二氧化碳用固体氢氧化锂(LiOH)吸收,生成碳酸锂和水,反应的化学方程式是。(4)、太空舱使用锂电池。Li可以通过Al与Li2O在高温下反应得到,同时生成氧化铝,该反应的化学方程式为。17. 在宏观、微观、符号之间建立联系,是化学学科的特点。(1)、按要求正确规范书写化学符号:
名称
氢氧化钙
硝酸银
氯化钠
2个镁离子
铵根离子
氧化铝
符号
(2)、如图所示是某密闭容器中物质变化过程的微观示意图:
①A,B,C中表示混合物的是。
②上述I、Ⅱ和Ⅲ变化中,属于化学变化的是 , 该化学变化中一定不变的粒子是(填粒子符号)。
18. 空气中氮气的含量最多,氮气在一定条件下可与某些物质发生反应。如图是以空气和其他必要的原料合成氮肥的工业流程图。请按要求回答下列问题: (1)、转化①中发生的是变化(选填“物理”或“化学”)。(2)、请写出转化②处发生的化合反应的化学方程式。(3)、标出氨气中氮元素的化合价为。(4)、氮肥中一定含有的元素有 , 你做出判断的依据是。(5)、下列有关空气的说法正确的是 。A、稀有气体可用于制作霓虹灯,利用了其化学性质 B、氮气充入食品包装中可以防腐,利用了其化学性质 C、二氧化硫、一氧化碳、二氧化碳都是空气污染物 D、空气中的氧气主要来源于植物的光合作用19. 定律是对自然现象或关系的描述。通常可用数学方式加以表达。在学习“质量守恒定律”时,小丽查阅到以下材料:
(1)、转化①中发生的是变化(选填“物理”或“化学”)。(2)、请写出转化②处发生的化合反应的化学方程式。(3)、标出氨气中氮元素的化合价为。(4)、氮肥中一定含有的元素有 , 你做出判断的依据是。(5)、下列有关空气的说法正确的是 。A、稀有气体可用于制作霓虹灯,利用了其化学性质 B、氮气充入食品包装中可以防腐,利用了其化学性质 C、二氧化硫、一氧化碳、二氧化碳都是空气污染物 D、空气中的氧气主要来源于植物的光合作用19. 定律是对自然现象或关系的描述。通常可用数学方式加以表达。在学习“质量守恒定律”时,小丽查阅到以下材料: (1)、玻义耳实验中,金属灰增加的质量是;(2)、质量守恒定律的发现过程,带给我们的启示有______(多选,填字母)。A、要善于总结前人的成果和经验 B、实验的成功与否,取决于药品的选择 C、定量方法是科学研究的重要方法 D、定量实验要尽量减少实验误差,使得实验更准确(3)、受上述研究启发,小丽对相关实验进行了深入探究。
(1)、玻义耳实验中,金属灰增加的质量是;(2)、质量守恒定律的发现过程,带给我们的启示有______(多选,填字母)。A、要善于总结前人的成果和经验 B、实验的成功与否,取决于药品的选择 C、定量方法是科学研究的重要方法 D、定量实验要尽量减少实验误差,使得实验更准确(3)、受上述研究启发,小丽对相关实验进行了深入探究。小丽选用白磷、锥形瓶、气球、天平等药品和器材,探究化学反应中物质质量的变化规律,装置如图。
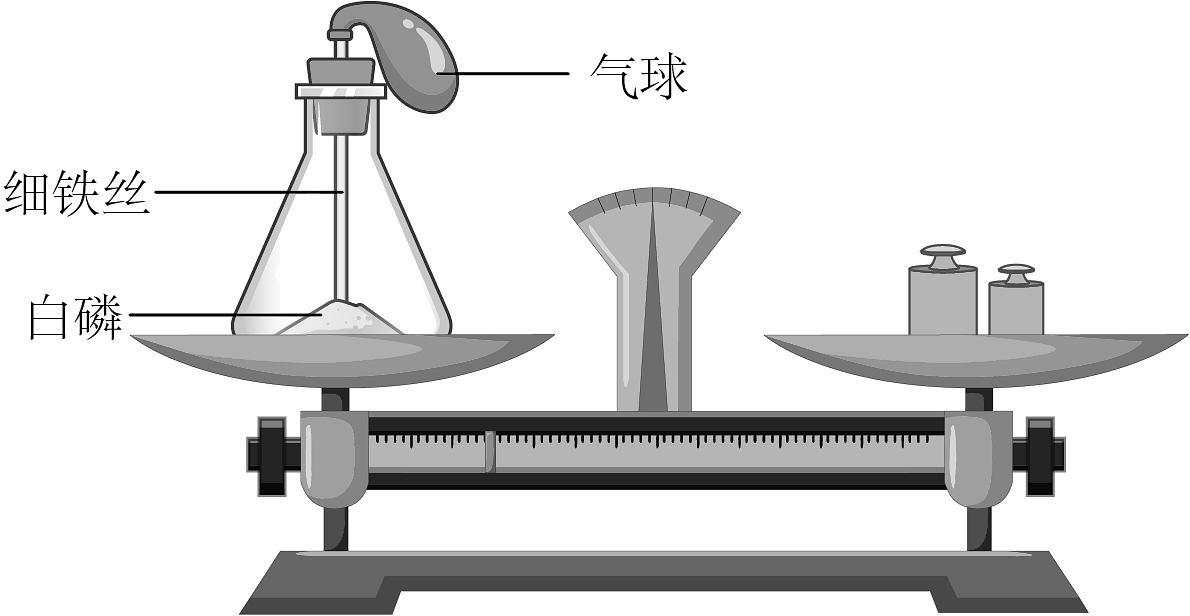
【实验思路】先确认化学反应已经发生,再比较反应物的质量总和和生成物的质量总和是否相等。
【实验步骤】
Ⅰ、锥形瓶内装入白磷,塞紧瓶塞放在天平托盘上,调节平衡;
Ⅱ、取下锥形瓶,将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并立即塞紧瓶塞;
①Ⅲ、待反应结束冷却后,将锥形瓶放回天平托盘上,观察。
【实验结论】参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
【交流反思】②要确认化学反应已经发生,本实验中观察到的现象是。
③反应结束后,若白磷有剩余,你认为是否仍能得出上述结论,并请说明理由。
④气球的作用有、。(答两点)
(4)、从微观看质量守恒定律。如图是某密闭容器中物质变化过程的微观示意图。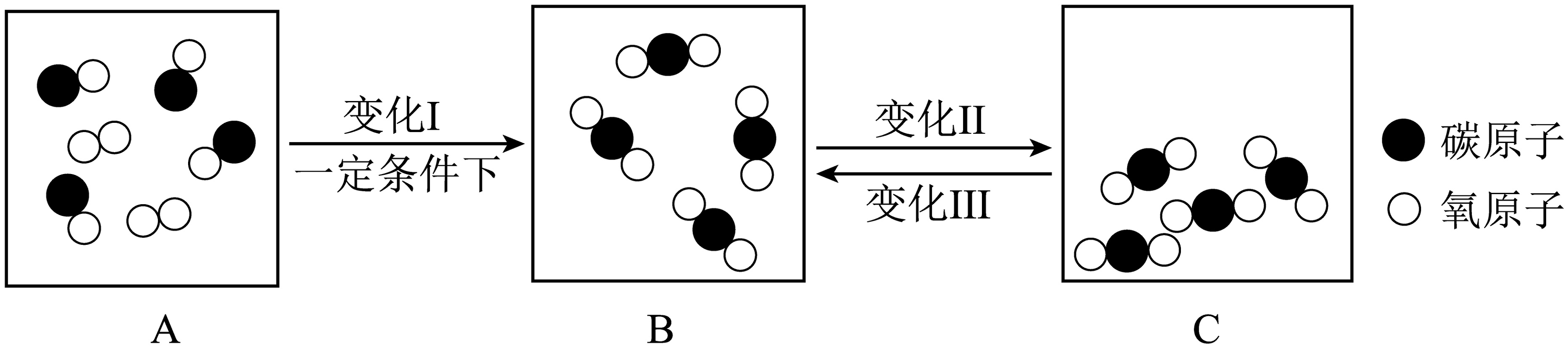
①上述变化Ⅰ、Ⅱ、Ⅲ中,属于化学变化的是 , 该变化的化学方程式为。
②变化I中,一定不变的微粒是(填微粒名称)。
20. 为测定实验室中某过氧化氢溶液中过氧化氢的质量,小明取过氧化氢溶液放入锥形瓶中,然后进行如图1所示的实验,有关质量变化如图2。 (1)、生成氧气的质量为。(2)、求此过氧化氢溶液中过氧化氢的质量。
(1)、生成氧气的质量为。(2)、求此过氧化氢溶液中过氧化氢的质量。