沪教版初中化学九年级上册单元测试-第六单元 金属资源综合利用(提升卷)
试卷更新日期:2025-09-11 类型:单元试卷
一、选择题
-
1. 通过实验可以验证物质的性质。下列试剂中,能验证铁、铜的金属活动性顺序的是A、蒸馏水 B、硝酸锌溶液 C、稀盐酸 D、澄清石灰水2. 金属活动性顺序可用来预测常见金属的某些化学性质。请你判断下列物质间能发生反应的是A、铜和稀硫酸 B、铝和硫酸镁溶液 C、锌和稀盐酸 D、银和硝酸铜溶液3. 《吕氏春秋》中记载“金(铜单质)柔锡(锡单质)柔,合两柔则刚”。这句话说明合金具有的特性是A、熔点一般比其组成金属的低 B、硬度一般比其组成金属的大 C、抗腐蚀性一般比其组成金属的强 D、耐磨性一般比其组成金属的好4. 黄金价格的疯狂上涨成了近期“热搜”。如图为金元素的相关信息,下列说法不正确的是
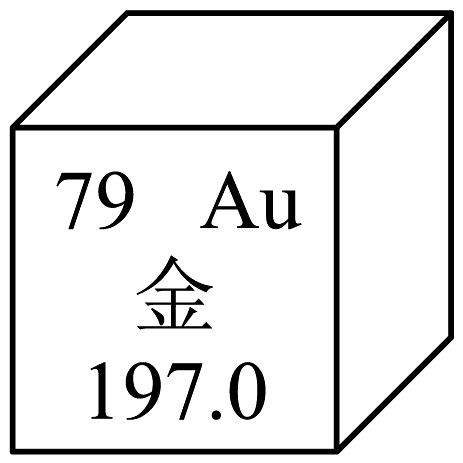 A、金原子中含有79个带负电的质子 B、金原子中含有118个不带电的中子 C、金的相对原子质量为197.0 D、金的化学性质比较稳定5. 为探究铁生锈的条件设计实验如下图,下列说法错误的是
A、金原子中含有79个带负电的质子 B、金原子中含有118个不带电的中子 C、金的相对原子质量为197.0 D、金的化学性质比较稳定5. 为探究铁生锈的条件设计实验如下图,下列说法错误的是 A、试管B应加入煮沸后迅速冷却的蒸馏水 B、试管A、E和F对应的铁钉一段时间后生锈 C、对比试管E和F可说明食盐能加快铁钉生锈 D、对比试管A和C,可推知铁生锈需要与水接触6. 用思维导图对常温或点燃条件下能与物质M发生反应的物质进行归纳整理,如图,则M可能是( )
A、试管B应加入煮沸后迅速冷却的蒸馏水 B、试管A、E和F对应的铁钉一段时间后生锈 C、对比试管E和F可说明食盐能加快铁钉生锈 D、对比试管A和C,可推知铁生锈需要与水接触6. 用思维导图对常温或点燃条件下能与物质M发生反应的物质进行归纳整理,如图,则M可能是( ) A、碳 B、铁 C、氧化铜 D、碳酸钙7. 下列化学知识的应用或解释正确的是A、自来水净水时使用氯气杀菌消毒,这一过程涉及化学变化 B、在空气中铝制品比铁制品更耐腐蚀,因为铝的金属活动性比铁弱 C、油锅着火,用锅盖盖上,是为了降低可燃物的温度 D、氧气能用于钢铁冶炼和金属焊接,利用了氧气的可燃性8. 将一定质量的锌粉放入硝酸亚铁和硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液。下列说法中正确的是( )A、若滤液呈浅绿色,则滤渣中只含有银 B、若滤渣中加稀盐酸有气泡产生,则滤液中一定含有两种溶质 C、若滤液为无色,则滤液中一定含有硝酸锌,可能含有硝酸银 D、将所得滤渣洗涤、干燥后称量,质量可能与所加锌粉的质量相等9. 甲、乙是与空气中常见气体有关的两个实验,下列说法正确的是
A、碳 B、铁 C、氧化铜 D、碳酸钙7. 下列化学知识的应用或解释正确的是A、自来水净水时使用氯气杀菌消毒,这一过程涉及化学变化 B、在空气中铝制品比铁制品更耐腐蚀,因为铝的金属活动性比铁弱 C、油锅着火,用锅盖盖上,是为了降低可燃物的温度 D、氧气能用于钢铁冶炼和金属焊接,利用了氧气的可燃性8. 将一定质量的锌粉放入硝酸亚铁和硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液。下列说法中正确的是( )A、若滤液呈浅绿色,则滤渣中只含有银 B、若滤渣中加稀盐酸有气泡产生,则滤液中一定含有两种溶质 C、若滤液为无色,则滤液中一定含有硝酸锌,可能含有硝酸银 D、将所得滤渣洗涤、干燥后称量,质量可能与所加锌粉的质量相等9. 甲、乙是与空气中常见气体有关的两个实验,下列说法正确的是 A、甲说明水是由H2和O2组成的 B、甲中正极和负极产生气体的质量比为1∶2 C、乙实验结束后②中的气球变小 D、对比乙中的①和③,说明铁生锈需要水10. 高铁建设因铁锈蚀报废了很多钢铁。同学们对影响铁锈蚀的因素进行如下探究。一段时间后,观察到图1中Ⅳ铁钉比Ⅰ中铁钉锈蚀更严重,Ⅱ、Ⅲ中铁钉无明显变化。按图2利用等浓度、等体积的、NaCl溶液分别进行实验,测得装置内氧气浓度的变化情况如图3。下列描述错误的是
A、甲说明水是由H2和O2组成的 B、甲中正极和负极产生气体的质量比为1∶2 C、乙实验结束后②中的气球变小 D、对比乙中的①和③,说明铁生锈需要水10. 高铁建设因铁锈蚀报废了很多钢铁。同学们对影响铁锈蚀的因素进行如下探究。一段时间后,观察到图1中Ⅳ铁钉比Ⅰ中铁钉锈蚀更严重,Ⅱ、Ⅲ中铁钉无明显变化。按图2利用等浓度、等体积的、NaCl溶液分别进行实验,测得装置内氧气浓度的变化情况如图3。下列描述错误的是 A、比较图1中Ⅰ、Ⅱ和Ⅰ、Ⅲ可得出铁生锈的条件 B、对比Ⅰ与Ⅳ以及图3可知铁生锈还与盐有关 C、由图3可知,两曲线呈“先陡后缓”的趋势的原因是氧气浓度下降 D、在三颈烧瓶接压强传感器,生铁粉末生锈后瓶内压强是起始的1/511. 常见金属R与硝酸银溶液反应的化学方程式为 有关该反应的说法正确的是( ).A、反应后溶液质量一定增加 B、该金属可能是铁 C、R 的活泼性比 Ag弱 D、R表面有固体析出12. 中国空间站系统建设所使用的下列材料中,属于金属材料的是( )A、建造空间站使用的碳纤维复合材料 B、制造载人飞船使用的滤紫外线石英玻璃 C、制作航天服使用的聚酰胺合成纤维 D、制造火箭使用的第三代铝锂合金13. 下列设计的实验方案能达到实验目的的是( )
A、比较图1中Ⅰ、Ⅱ和Ⅰ、Ⅲ可得出铁生锈的条件 B、对比Ⅰ与Ⅳ以及图3可知铁生锈还与盐有关 C、由图3可知,两曲线呈“先陡后缓”的趋势的原因是氧气浓度下降 D、在三颈烧瓶接压强传感器,生铁粉末生锈后瓶内压强是起始的1/511. 常见金属R与硝酸银溶液反应的化学方程式为 有关该反应的说法正确的是( ).A、反应后溶液质量一定增加 B、该金属可能是铁 C、R 的活泼性比 Ag弱 D、R表面有固体析出12. 中国空间站系统建设所使用的下列材料中,属于金属材料的是( )A、建造空间站使用的碳纤维复合材料 B、制造载人飞船使用的滤紫外线石英玻璃 C、制作航天服使用的聚酰胺合成纤维 D、制造火箭使用的第三代铝锂合金13. 下列设计的实验方案能达到实验目的的是( ) A、用方案甲探究不同催化剂对H2O2分解速率的影响 B、用方案乙探究温度对分子运动速率的影响 C、用方案丙探究氧气浓度对反应剧烈程度的影响 D、用方案丁探究铁、铜、银三种金属的活动性相对强弱14. 将一定量铁粉加入含有Cu(NO3)2和AgNO3两种溶质的溶液中,充分反应后过滤,得到滤液和滤渣。则下列说法正确的是( )A、若滤液中有AgNO3 , 则滤渣中一定没有Cu、Ag B、若滤渣成分为Cu、Ag、Fe,则滤液中溶质只有一种 C、若滤渣成分为Cu、Ag,则滤液中一定有Fe(NO3)3 D、若滤液中有Cu(NO3)2 , 则滤渣中加入稀硫酸一定会有气泡产生15. 在日常生活、工农业生产和科学研究中,大量使用金属材料。下列说法正确的是( )A、常温下,所有金属单质均是固体 B、铝制品具有很好的抗腐蚀性,说明铝的金属活动性比较弱 C、合金的硬度一般比其组成金属的硬度大 D、合金中只含金属元素
A、用方案甲探究不同催化剂对H2O2分解速率的影响 B、用方案乙探究温度对分子运动速率的影响 C、用方案丙探究氧气浓度对反应剧烈程度的影响 D、用方案丁探究铁、铜、银三种金属的活动性相对强弱14. 将一定量铁粉加入含有Cu(NO3)2和AgNO3两种溶质的溶液中,充分反应后过滤,得到滤液和滤渣。则下列说法正确的是( )A、若滤液中有AgNO3 , 则滤渣中一定没有Cu、Ag B、若滤渣成分为Cu、Ag、Fe,则滤液中溶质只有一种 C、若滤渣成分为Cu、Ag,则滤液中一定有Fe(NO3)3 D、若滤液中有Cu(NO3)2 , 则滤渣中加入稀硫酸一定会有气泡产生15. 在日常生活、工农业生产和科学研究中,大量使用金属材料。下列说法正确的是( )A、常温下,所有金属单质均是固体 B、铝制品具有很好的抗腐蚀性,说明铝的金属活动性比较弱 C、合金的硬度一般比其组成金属的硬度大 D、合金中只含金属元素二、填空题
-
16. 现有和的混合溶液195.2g,向其中加入铁粉,反应的先后顺序: , , 加入铁粉质量与反应后溶液中剩余固体质量的关系如图所示。
 (1)、加入a g铁粉时,溶液中的阳离子为。(2)、m(剩余固体)>6.4g时,剩余固体的成分是。(3)、原和的混合溶液中的质量为g。(4)、当加入11.2g铁粉时,反应后所得溶液的质量分数。(5)、当加入16.8g铁粉时,剩余固体中和的质量比为。17. 化学与人类生产生活息息相关,生产生活中蕴含着许多化学知识。(1)、《吕氏春秋·别类篇》载有“金(铜)柔锡柔,合两柔则刚”,这句话表明合金具有的特性是比组成它的纯金属硬度(选填“大”或“小”)。(2)、《本草纲目》记载:“其法用浓酒和糟入瓶,蒸令气上,用器取滴露。”
(1)、加入a g铁粉时,溶液中的阳离子为。(2)、m(剩余固体)>6.4g时,剩余固体的成分是。(3)、原和的混合溶液中的质量为g。(4)、当加入11.2g铁粉时,反应后所得溶液的质量分数。(5)、当加入16.8g铁粉时,剩余固体中和的质量比为。17. 化学与人类生产生活息息相关,生产生活中蕴含着许多化学知识。(1)、《吕氏春秋·别类篇》载有“金(铜)柔锡柔,合两柔则刚”,这句话表明合金具有的特性是比组成它的纯金属硬度(选填“大”或“小”)。(2)、《本草纲目》记载:“其法用浓酒和糟入瓶,蒸令气上,用器取滴露。”粮食放入甑桶中,加入酒曲发酵酿酒发生的是(填“缓慢氧化”或“剧烈氧化”)。该酿酒工艺中还利用了化学实验操作中原理。
(3)、菜熟后关闭燃气灶开关,灶火熄灭,其灭火原理是。化石燃料日趋枯竭,人类正在积极开发新能源,请列举一种新能源。(4)、水杯表面耐高温的PP涂层不仅美观,而且可以有效防止铁与同时接触而生锈。(5)、海盐是人类最早从海洋中获取的矿物质之一,海盐中的氯化钠由构成。(填微粒符号)18.金属材料的广泛应用,极大地促进了社会发展。
某校化学兴趣小组以“金属材料”为主题开展项目式学习。
【项目一】金属材料的应用小组中的同学寻找了家中几种金属制品,请你帮助他说出分别与金属的哪些性质有关系。

(1)结合图可知,铁可做炊具说明铁具有良好的________。
(2)铝制垃圾桶相对于铁质垃圾桶的优点是________(写出一点即可)。
【项目二】金属的生锈条件探究
小组同学取三枚大小相同的洁净无锈铁钉分别放入试管,进行图1实验,现象如表。

试管编号
A
B
C
一周后铁钉表面现象
有一层铁锈
无明显变化
无明显变化
(3)对比试管中实验现象,说明铁锈蚀是铁与空气中的________(填化学式)发生化学反应。
(4)经查阅资料铜锈的主要成分为碱式碳酸铜。由此可以推测铜生锈的条件为_____。(填字母)
A. 和 B. 和 C. 和 D. 和 【项目三】金属活动性探究
为了验证生活中常见的铁、铜、银三种金属的活动性顺序,兴趣小组同学又进行了以下探究。
【设计实验】设计的实验方案如图Ⅰ、Ⅱ所示。(所用金属均已打磨,形状与大小均相同)

【进行实验】
(5)实验Ⅰ中随着反应进行,溶液颜色的变化为________;实验Ⅱ中发生反应的方程式为________。
【交流与讨论】
(6)同学们发现通过此实验方案不能比较铁、铜、银三种金属的活动性顺序强弱。经过同学们的讨论,在上述实验方案的基础上,补充了一个实验(图Ⅲ所示),实现了探究目的,若X是铜片,则Y可能是________溶液。
(7)小组中又有同学提出可以通过调整反应顺序,只用Ⅰ、Ⅱ中所用的药品(即铁片、铜片和硝酸银溶液)就能得出三种金属的活动性,此同学说法________(填“合理”或“不合理”)。
【实验结论】最终同学们成功地得出铁、铜、银的金属活动性顺序。
19. 金属的冶炼和利用,促进了人类的发展。(1)、明代的《菽园杂记》中记载:“用矿二百五十箩…入大旋风炉,连烹三日三夜,方见成铜。”文中的矿指硫化矿,其主要成分是Cu2S。查阅资料得知,Cu2S和氧气在高温下反应生成铜与二氧化硫,该反应的化学方程式为:。(2)、常见含铁矿石有赤铁矿、磁铁矿、菱铁矿(主要成分FeCO3)等,FeCO3中铁元素的化合价为。(3)、常见的水龙头材质主要有塑料、锌合金、不锈钢、铜等。其中镀铬的铜质水龙头越来越受到消费者喜爱。I.调查铜质水龙头镀铬的目的
【查阅资料】
资料1:铜质水龙头随着使用时间的推移,表面可能会出现氧化变色现象。
资料2:铬(Cr)是一种银白色金属,在室温下化学性质稳定,具有很高的耐腐蚀性。
资料3:铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【分析交流】
①不锈钢的主要成分是 , 铜质水龙头镀铬的主要目的是。
Ⅱ.探究铬和铁的活动性顺序
②【设计实验】
实验步骤
预期现象
结论
将铬片用砂纸打磨后放入试管中,加入适量FeCO3溶液。
铬的活动性比铁强
③该实验中有关反应的化学方程式为。
20. 黄铜(铜锌合金)具有良好的可塑性和耐腐蚀性,常用于制作金色饰品。某兴趣小组进行如图所示实验:取黄铜样品置于烧杯中,慢慢加入稀硫酸,恰好完全反应。请计算: (1)、该黄铜样品中含锌的质量为g。(2)、所用稀硫酸中溶质的质量分数。
(1)、该黄铜样品中含锌的质量为g。(2)、所用稀硫酸中溶质的质量分数。