(浙教版)科学九年级上册第1章物质及其变化 专练5 技术、工程与社会
试卷更新日期:2025-09-04 类型:复习试卷
一、传统工艺型
-
1. “捶草印花”是一种起源于明清时期的传统草木印染工艺。捶打植物花叶,使汁液浸染在布料上印出图案,某小组通过下列各环节体验印染过程。
 (1)、布料清洗:先用碱去除布料上的油脂,漂洗后再加醋酸调节至中性。请写出利用pH试纸测定溶液 pH 的方法:。(2)、捶打印花:通过捶打使牵牛花细胞中的液泡破裂,细胞液渗入白布中。捶打牵牛花过程中发生的是(选填“物理”或“化学”)变化。(3)、印花调色:通过调节溶液pH使布料呈现不同颜色。牵牛花颜色随溶液酸碱性变化如表所示。将印花后的布放入水中,往水中加入碳酸钠后,渗有牵牛花汁的布料颜色为。
(1)、布料清洗:先用碱去除布料上的油脂,漂洗后再加醋酸调节至中性。请写出利用pH试纸测定溶液 pH 的方法:。(2)、捶打印花:通过捶打使牵牛花细胞中的液泡破裂,细胞液渗入白布中。捶打牵牛花过程中发生的是(选填“物理”或“化学”)变化。(3)、印花调色:通过调节溶液pH使布料呈现不同颜色。牵牛花颜色随溶液酸碱性变化如表所示。将印花后的布放入水中,往水中加入碳酸钠后,渗有牵牛花汁的布料颜色为。花种类
酸碱性
酸性
中性
碱性
牵牛花
红色
紫色
蓝色
2. 侯氏氨碱法生产纯碱主要的工艺流程如下: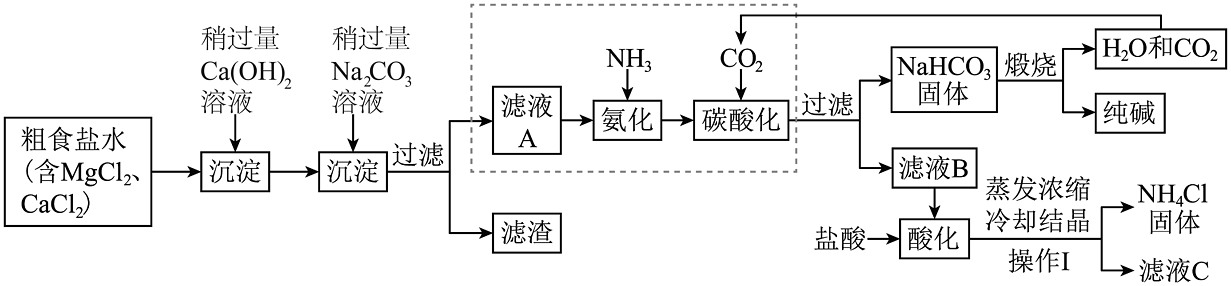
【资料】如图中虚线框内的主要反应为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,CO2+H2O+Na2CO3=2NaHCO3;碳酸氢钠在20C时溶解度为9.6g,在50℃以上开始分解生成碳酸钠、水和二氧化碳;碳酸氢钠的溶解度受温度影响较大。请完成下列各题:
(1)、操作I的名称 , 如在实验室进行此操作,其中玻璃棒的作用是。(2)、写出NH4Cl的一种用途;在该工艺流程中能循环使用的物质有。(3)、加入稍过量Ca(OH)2溶液后反应的化学方程式为;滤液B加入盐酸后反应的化学方程式为。(4)、为除尽粗食盐水中的氯化钙和氯化镁,加入的氢氧化钙和碳酸钠试剂的先后顺序不能颠倒,原因是。3. 织物处理工艺中蕴含着很多的科学知识。请回答:(1)、古法工艺:采用贝壳灼烧而成的灰烬(主要成分CaO)和草木灰(含)在水中浸泡并不断搅拌,得到强碱性溶液,用于织物的处理。浸泡获取强碱性溶液时,发生的化学反应有:
Ⅰ.;
Ⅱ.。
组别
酸
加入酸的体积(毫升)
溶液pH
1
3.6%醋酸()
10.1
6.7
30.0
4.4
2
3.6%盐酸()
5.9
11.4
6.1
3.6
3
0.012%盐酸()
1824
8.2
1825
7.0
①Ⅰ的化学反应类型是。
②该强碱性溶液中,有效成分是。
(2)、现代工艺:通常用氢氧化钠溶液来处理织物。①配制100千克溶质的质量分数为0.4%的氢氧化钠溶液,需要溶质的质量分数为20%的氢氧化钠溶液多少千克?
②碱液处理后的织物,用醋酸调节pH至7.5~4.0之间。为什么用醋酸呢?表中是在60毫升0.4%的氢氧化钠溶液()中加入酸的体积和溶液pH的部分数据。根据表中信息,解释使用醋酸的原因。
二、现代化工型
-
4. 近年来,空气中二氧化碳体积分数逐年增加。2023年,其体积分数已高达0.04%,对全球气候造成重大影响。我国向国际社会郑重承诺,努力争取在2060年前实现“碳中和”。工业上会采用氢氧化钠溶液喷淋的方法来处理二氧化碳含量高的空气(如图),反应的化学方程式:。这项技术与工业制碱和石灰石煅烧技术连用,在降低大气中二氧化碳含量的同时,生产出多种化工产品。
 (1)、氢氧化钠溶液采用喷雾的形式,目的是;(2)、反应塔进气量为升/小时,二氧化碳密度约为2克/升。若反应塔连续工作一昼夜,至少需要氢氧化钠多少克?(保留1位小数)5. 网红产品自嗨锅深受年轻人喜欢。自嗨锅内有一个发热包(主要成分为生石灰、铝粒、碳酸钠),加入冷水后可迅速升温从而加热食物。
(1)、氢氧化钠溶液采用喷雾的形式,目的是;(2)、反应塔进气量为升/小时,二氧化碳密度约为2克/升。若反应塔连续工作一昼夜,至少需要氢氧化钠多少克?(保留1位小数)5. 网红产品自嗨锅深受年轻人喜欢。自嗨锅内有一个发热包(主要成分为生石灰、铝粒、碳酸钠),加入冷水后可迅速升温从而加热食物。

(1)小滨猜想发热包放热原理是生石灰与水反应放热,其化学方程式为:。
(2)为了验证上述猜想,小滨取发热剂和生石灰各 , 分别与等量的水反应,水温随时间变化的情况如图所示。根据图像,小滨认为:“生石灰与水反应放热”不是发热包放热的主要原因,理由是。
(3)通过查阅资料得知,铝会与氢氧化钠发生反应并放热,化学反应方程式为:。
(4)发热剂使用后的废液中含有氢氧化钠、碳酸钠等物质,因而碱性较强,需调节至中性再处理,可以采取的方法是:往废液中加入酚酞试液,再。
6. 钨(W)是当代高科技新材料的重要组成部分。如图是一种生产钨的工业流程:
【查阅资料】①白钨矿的主要成分是钨酸钙(),还含有CaO、等。
②。
③钨酸()是难溶于水的黄色固体。
(1)操作1粉碎白钨矿的目的是。
(2)根据图中信息推断具有的性质是。
(3)操作2后所得滤液中一定含有的溶质是。(写出化学式)
三、农业生产型
-
7. 农技人员采用“测土配方”技术对一片果园进行了土壤检测,结果显示该果园需要补充一定量的氮元素和钾元素.(1)、氮是植物生长的重要元素,果园土壤中缺少氮元素,需要用氮肥来补充,下列属于氮肥的是(填序号).①KCl;②NH4HCO3;③Ca3(PO4)2 .(2)、某同学取丰收牌钾肥(如图1)样品2.0g,溶于足量的水中,滴加过量氯化钡溶液,产生沉淀质量与所加氯化钡溶液质量的关系如图2。试计算该钾肥样品中硫酸钾的质量分数?判断是否符合产品外包装说明?(反应方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应.)
 8. 2020年2月, 习近平总书记对全国春季农业生产工作作出重要指示, 强调要提升农业科技创新水平并加快推广使用,增强粮食生产能力和防灾减灾能力。为打赢疫情防控阻击战、实现全年经济社会发展目标任务,提供有力支撑。化肥和农药的使用,使人类实现了由传统农业到现代农业的跨越, 它们对粮食增产都有非常重要的作用。
8. 2020年2月, 习近平总书记对全国春季农业生产工作作出重要指示, 强调要提升农业科技创新水平并加快推广使用,增强粮食生产能力和防灾减灾能力。为打赢疫情防控阻击战、实现全年经济社会发展目标任务,提供有力支撑。化肥和农药的使用,使人类实现了由传统农业到现代农业的跨越, 它们对粮食增产都有非常重要的作用。
 (1)、下列关于农药的说法中, 错误的是 (填序号)。A、波尔多液(含有CuSO4)不能在铁制容器中配制和储存 B、积极研发新型高效、低毒、低残留农药 C、积极推进化肥减量提效、农药减量控害“双行动” D、失效或剩余的农药,直接倒在田间地头或水井溪流(2)、在蔬菜大棚高处悬挂盛有稀硫酸的塑料桶, 每天向其中加入一定量的碳酸氢铵固体, 其反应原理为2NH4HCO3+H2SO4=(NH)2SO4+2H2O+2CO2↑,这将有助于促进蔬菜的光合作用, 提高农作物产量。当稀硫酸反应完后,桶内剩余物质中的((NH4)2SO4属于铵态氮肥, 它(填“能”或“不能”)与常见的碱性物质氢氧化钙Ca(OH)2混合施用, 理由是(3)、(NH)2SO4也可用于配制阳台无土栽培蔬菜的营养液,该配方中除了((NH4)2SO4外, 还有Ca(NO3)2、K2SO4、KH2PO4等成分, 其中属于复合肥的成分是9. 蔬菜水果是人们必备的食物,清除瓜果、蔬菜表面的残留农药、细菌等关系人的健康。小明利用鸡蛋壳和食盐自制天然果蔬清洗盐,制作过程如图甲。
(1)、下列关于农药的说法中, 错误的是 (填序号)。A、波尔多液(含有CuSO4)不能在铁制容器中配制和储存 B、积极研发新型高效、低毒、低残留农药 C、积极推进化肥减量提效、农药减量控害“双行动” D、失效或剩余的农药,直接倒在田间地头或水井溪流(2)、在蔬菜大棚高处悬挂盛有稀硫酸的塑料桶, 每天向其中加入一定量的碳酸氢铵固体, 其反应原理为2NH4HCO3+H2SO4=(NH)2SO4+2H2O+2CO2↑,这将有助于促进蔬菜的光合作用, 提高农作物产量。当稀硫酸反应完后,桶内剩余物质中的((NH4)2SO4属于铵态氮肥, 它(填“能”或“不能”)与常见的碱性物质氢氧化钙Ca(OH)2混合施用, 理由是(3)、(NH)2SO4也可用于配制阳台无土栽培蔬菜的营养液,该配方中除了((NH4)2SO4外, 还有Ca(NO3)2、K2SO4、KH2PO4等成分, 其中属于复合肥的成分是9. 蔬菜水果是人们必备的食物,清除瓜果、蔬菜表面的残留农药、细菌等关系人的健康。小明利用鸡蛋壳和食盐自制天然果蔬清洗盐,制作过程如图甲。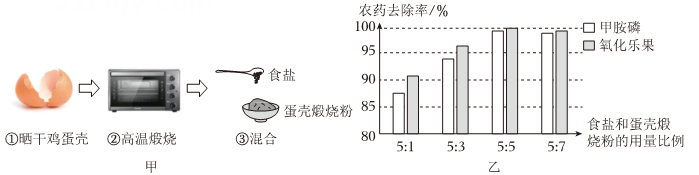 (1)、已知鸡蛋壳含碳酸钙90%,其煅烧化学方程式为 求100克鸡蛋壳完全煅烧后生成蛋壳煅烧粉(CaO)多少克?(2)、小明探究不同比例果蔬清洗粉的除去甲胺磷和氧化乐果两种杀虫剂的效果如图乙,食盐与蛋壳煅烧粉的最佳比例为。(3)、甲胺磷和氧化乐果两种杀虫剂呈酸性,自制果蔬清洗粉能高效去除甲胺磷和氧化乐果两种杀虫剂的可能原因是。(写出1点)10. 今年两会期间,习近平总书记强调:农业强国是社会主义强国的根基,粮食生产则是“三农”工作的重中之重。使用化肥是农业生产中重要的增产手段。(1)、常见的氮肥:①硝酸铵②尿素[]③氯化铵,含氮量由大到小的顺序是(填序号)。(2)、取上述三种氮肥分别加熟石灰研磨,可快速检出尿素,依据的现象是。要将硝酸铵转化为一种复合肥料,可选用的反应物是。(3)、某化肥包装袋标签上的部分内容如图。化学兴趣小组为测定该化肥的纯度,取12.5g样品配制成溶液,向其中滴加溶液至不再产生沉淀为止。过滤、洗涤、干燥,得到的沉淀质量为28.7g。通过计算判断该化肥是否合格。
(1)、已知鸡蛋壳含碳酸钙90%,其煅烧化学方程式为 求100克鸡蛋壳完全煅烧后生成蛋壳煅烧粉(CaO)多少克?(2)、小明探究不同比例果蔬清洗粉的除去甲胺磷和氧化乐果两种杀虫剂的效果如图乙,食盐与蛋壳煅烧粉的最佳比例为。(3)、甲胺磷和氧化乐果两种杀虫剂呈酸性,自制果蔬清洗粉能高效去除甲胺磷和氧化乐果两种杀虫剂的可能原因是。(写出1点)10. 今年两会期间,习近平总书记强调:农业强国是社会主义强国的根基,粮食生产则是“三农”工作的重中之重。使用化肥是农业生产中重要的增产手段。(1)、常见的氮肥:①硝酸铵②尿素[]③氯化铵,含氮量由大到小的顺序是(填序号)。(2)、取上述三种氮肥分别加熟石灰研磨,可快速检出尿素,依据的现象是。要将硝酸铵转化为一种复合肥料,可选用的反应物是。(3)、某化肥包装袋标签上的部分内容如图。化学兴趣小组为测定该化肥的纯度,取12.5g样品配制成溶液,向其中滴加溶液至不再产生沉淀为止。过滤、洗涤、干燥,得到的沉淀质量为28.7g。通过计算判断该化肥是否合格。氯化铵
净重25kg
纯度≥92%
XX化肥有限责任公司