浙江省杭州市萧山区八校2024-2025学年九年级上学期11月期中科学试题
试卷更新日期:2024-12-14 类型:期中考试
一、选择题(每题3分,共45分)
-
1. 下列关于酸碱溶液配制及其性质实验的操作,正确的是( )A、
 称量NaOH固体
B、
称量NaOH固体
B、 配制NaOH溶液
C、
配制NaOH溶液
C、 稀释浓H2SO4
D、
稀释浓H2SO4
D、 测稀H2SO4的pH
2. 一般地说,金属越活泼,冶炼越困难,则甲代表的金属是( )
测稀H2SO4的pH
2. 一般地说,金属越活泼,冶炼越困难,则甲代表的金属是( )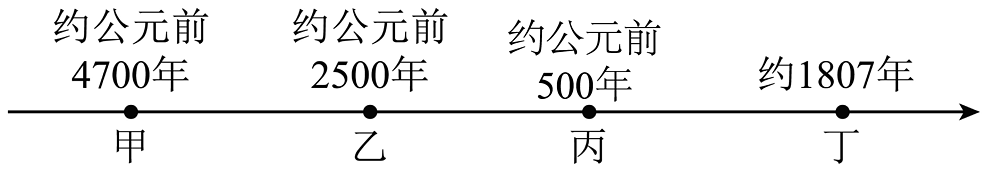 A、铁 B、铜 C、钠 D、锌3. 在①氧化铜②金属镁③氢氧化钠溶液④硝酸钡溶液这四种物质中,跟稀硫酸能发生反应且反应中表现了“酸的通性”的组合是( )A、①②③ B、②③④ C、①③④ D、①②③④4. 下图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是 ( )
A、铁 B、铜 C、钠 D、锌3. 在①氧化铜②金属镁③氢氧化钠溶液④硝酸钡溶液这四种物质中,跟稀硫酸能发生反应且反应中表现了“酸的通性”的组合是( )A、①②③ B、②③④ C、①③④ D、①②③④4. 下图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是 ( ) A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、氢氧化钠溶液中存在的粒子是Na+和OH- D、该反应的实质是H+和OH-结合生成H2O分子5. 下列各项实验操作,能达到目的的是( )A、加入适量的CaCl2溶液,可以达到已经部分变质的NaOH除杂的目的 B、为除去MnO2固体中的KCl,必须经过溶解、过滤、蒸发结晶的过程 C、用加入适量铜粉再过滤的方法除去Cu(NO3)2溶液中混有的AgNO3 D、向某无色未知溶液中加入BaCl2溶液,以检验溶液中的存在6. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )
A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、氢氧化钠溶液中存在的粒子是Na+和OH- D、该反应的实质是H+和OH-结合生成H2O分子5. 下列各项实验操作,能达到目的的是( )A、加入适量的CaCl2溶液,可以达到已经部分变质的NaOH除杂的目的 B、为除去MnO2固体中的KCl,必须经过溶解、过滤、蒸发结晶的过程 C、用加入适量铜粉再过滤的方法除去Cu(NO3)2溶液中混有的AgNO3 D、向某无色未知溶液中加入BaCl2溶液,以检验溶液中的存在6. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( ) A、甲、乙、丙依次可能是、、 B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙7. 钴(Co)的金属活动性与铁相似,钴的化合物相关性质如表。下列预测合理的是( )
A、甲、乙、丙依次可能是、、 B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙7. 钴(Co)的金属活动性与铁相似,钴的化合物相关性质如表。下列预测合理的是( )物质
CoO
Co(OH)2
CoCl2
CoCO3
在水中的溶解性
难溶,灰绿色固体
难溶,粉红色固体
易溶,溶液呈粉红色
难溶,粉红色固体
A、Co能从MgCl2溶液中置换出Mg B、CoO能与盐酸反应得到粉红色溶液 C、CoCO3能与盐酸反应生成H2 D、Co(OH)2可由Co与NaOH溶液反应制得8. 第19届亚运会于2023年9月23日至10月8日在杭州举办,下列说法不正确的是( )A、主体育场屋面采用的新材料铝镁锰板合金,属于有机合成材料 B、亚运火炬“薪火”的主要燃料是甲醇(),属于有机物 C、主体育场的“花瓣”钢结构造型采用压弯成型技术,利用了金属的延展性 D、亚运会开闭幕式首次使用“数字烟花”代替“实物烟花”,体现了绿色环保理念9. 不同品牌的洗手液pH一般不同,25℃时四种洗手液的pH如图所示。下列说法错误的是( ) A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于710. 久置NaOH易变质,为检验一瓶久置NaOH溶液是否已完全变质,有以下几种验证方法,其中正确的是( )
A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于710. 久置NaOH易变质,为检验一瓶久置NaOH溶液是否已完全变质,有以下几种验证方法,其中正确的是( )①用pH试纸测得反应后的溶液pH大于7,表示NaOH未完全变质;
②不断滴加稀盐酸,如果一段时间后出现气泡,表示NaOH未完全变质;
③滴加过量 , 过滤后在滤液中滴加酚酞,如果变红,表示NaOH未完全变质;
④滴加过量反应后取上层清液,滴加无沉淀生成,表示NaOH完全变质。
A、①② B、②③ C、②④ D、③④11. 重结晶后的食盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以、Ca2+、Mg2+的形式存在,为将这些杂质除净,可向食盐溶液中加入过量的氢氧化钠、碳酸钠、氯化钡溶液,最后经过过滤、蒸发得到精盐。下列操作及加入溶液顺序错误的是( )A、BaCl2、NaOH、Na2CO3、过滤、HCl B、BaCl2、Na2CO3、NaOH、过滤、HCl C、NaOH、BaCl2、Na2CO3、过滤、HCl D、Na2CO3、BaCl2、NaOH、过滤、HCl12. 向100g质量分数分别为14.6%HCl和12%MgSO4的混合溶液中,滴加Ba(OH)2溶液至过量。下列图象中,产生的沉淀量与滴入Ba(OH)2相符的是( )A、 B、
B、 C、
C、 D、
D、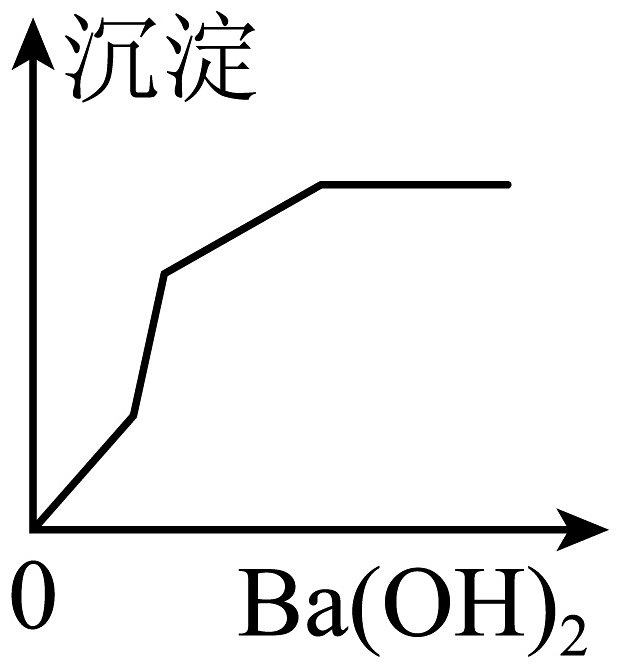 13. 用图像表示化学变化可以提升思维能力,以下四个图像对应的变化过程正确的是( )
13. 用图像表示化学变化可以提升思维能力,以下四个图像对应的变化过程正确的是( )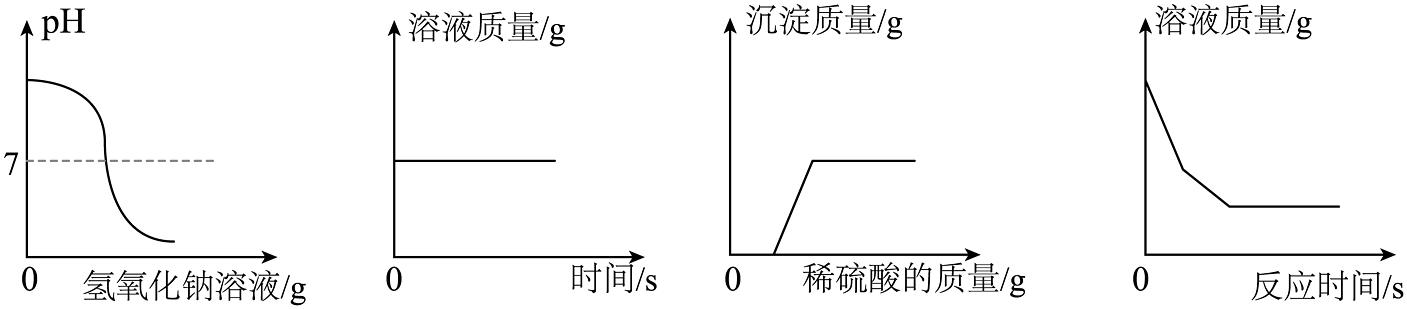 A、向稀盐酸中滴加过量的氢氧化钠溶液 B、浓硫酸长时间露置于空气中 C、向NaOH和BaCl2的混合溶液中加入足量的稀硫酸 D、向足量的硫酸铜溶液中加入铁和镁固体混合物14. 表面布满铁锈(铁锈的主要成分是Fe2O3)的铁钉放入盛有稀硫酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。下列分析正确的是( )
A、向稀盐酸中滴加过量的氢氧化钠溶液 B、浓硫酸长时间露置于空气中 C、向NaOH和BaCl2的混合溶液中加入足量的稀硫酸 D、向足量的硫酸铜溶液中加入铁和镁固体混合物14. 表面布满铁锈(铁锈的主要成分是Fe2O3)的铁钉放入盛有稀硫酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。下列分析正确的是( ) A、d点时H2SO4反应完,且温度高于a点 B、整个反应过程,溶液中逐渐减少 C、当压强为115千帕时,溶液中的溶质只有FeSO4 D、cd段压强减小是因为铁和稀硫酸反应结束,不再放热15. 推理是学习科学的一种重要方法,下列推理合理的是( )A、阳离子是带正电荷的粒子,则带正电荷的粒子一定是阳离子 B、单质是由同种元素组成的,则只含一种元素的纯净物一定是单质 C、酸和碱反应有盐和水生成,则有盐和水生成的反应一定是酸和碱发生反应 D、碱中都有氢、氧元素,所以含氢、氧元素的化合物都是碱
A、d点时H2SO4反应完,且温度高于a点 B、整个反应过程,溶液中逐渐减少 C、当压强为115千帕时,溶液中的溶质只有FeSO4 D、cd段压强减小是因为铁和稀硫酸反应结束,不再放热15. 推理是学习科学的一种重要方法,下列推理合理的是( )A、阳离子是带正电荷的粒子,则带正电荷的粒子一定是阳离子 B、单质是由同种元素组成的,则只含一种元素的纯净物一定是单质 C、酸和碱反应有盐和水生成,则有盐和水生成的反应一定是酸和碱发生反应 D、碱中都有氢、氧元素,所以含氢、氧元素的化合物都是碱二、填空题(每空2分,共40分)
-
16. 下列物质中:①空气 ②氯化钠溶液 ③食醋 ④汞 ⑤生铁 ⑥冰水混合物 ⑦稀硫酸
⑧氢气 ⑨二氧化碳。属于混合物的是 , 属于单质的是。 (填序号)
17. 金属的用途很广,我们应该节约和保护金属资源,请根据如图实验回答下列问题: (1)、实验结果是实验①中的铁钉生锈了,而实验②、③的铁钉没有生锈,则根据实验结果可以得出铁生锈主要是铁与发生反应。(2)、为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前需要加入稀硫酸除去铁锈,化学方程式为。18. 某化学活动小组以“酸的化学性质”为主题进行探究性实验学习,请根据如图实验回答下列问题:
(1)、实验结果是实验①中的铁钉生锈了,而实验②、③的铁钉没有生锈,则根据实验结果可以得出铁生锈主要是铁与发生反应。(2)、为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前需要加入稀硫酸除去铁锈,化学方程式为。18. 某化学活动小组以“酸的化学性质”为主题进行探究性实验学习,请根据如图实验回答下列问题: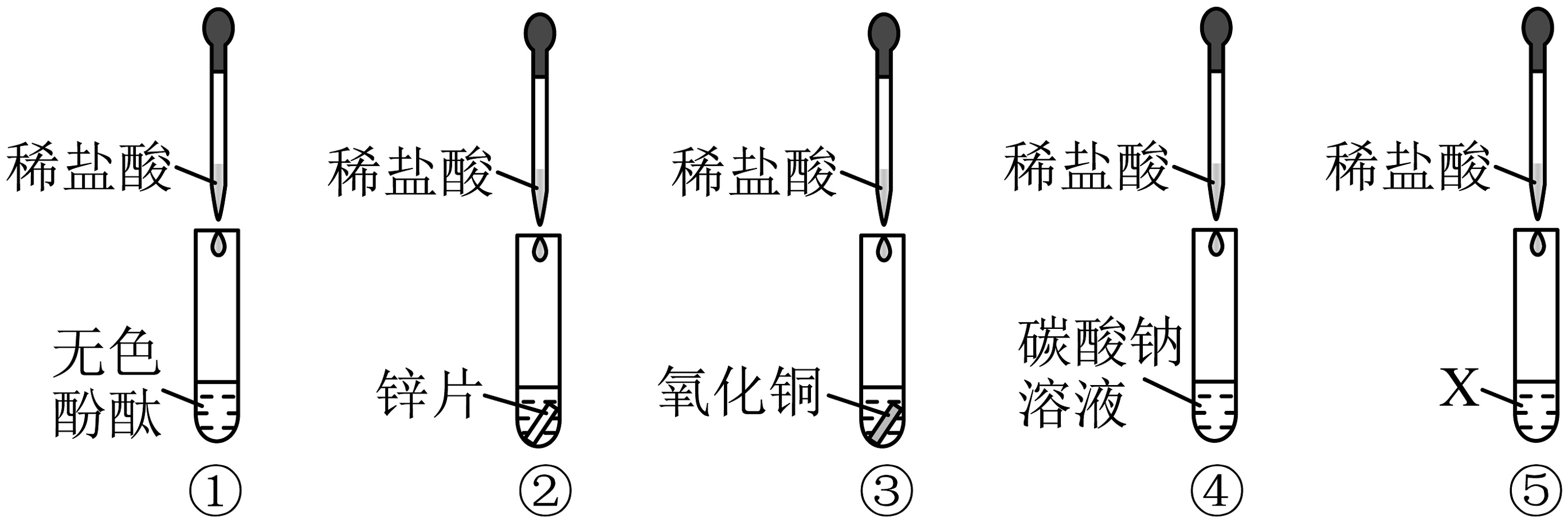 (1)、实验①②③④中观察到产生气泡是试管。(填序号)(2)、实验中观察到试管⑤中物质变黄色溶液,固体X可能是。(3)、取试管③中溶液,逐滴滴加氢氧化钠溶液,发现一段时间后才会有蓝色沉淀产生,则试管③中溶液的溶质是。(4)、将试管①和试管④中溶液都倒入同一烧杯中充分进行混合,有气泡产生且最终溶液呈红色,烧杯中溶液含有的溶质为(除酚酞外)。19. 氢气、木炭、一氧化碳是金属冶炼中常用的还原剂。如图甲、乙、丙均是金属冶炼的三个实验装置。其中丙实验中酒精喷灯给试管加热部位顺序依次为炭粉、氧化铜。
(1)、实验①②③④中观察到产生气泡是试管。(填序号)(2)、实验中观察到试管⑤中物质变黄色溶液,固体X可能是。(3)、取试管③中溶液,逐滴滴加氢氧化钠溶液,发现一段时间后才会有蓝色沉淀产生,则试管③中溶液的溶质是。(4)、将试管①和试管④中溶液都倒入同一烧杯中充分进行混合,有气泡产生且最终溶液呈红色,烧杯中溶液含有的溶质为(除酚酞外)。19. 氢气、木炭、一氧化碳是金属冶炼中常用的还原剂。如图甲、乙、丙均是金属冶炼的三个实验装置。其中丙实验中酒精喷灯给试管加热部位顺序依次为炭粉、氧化铜。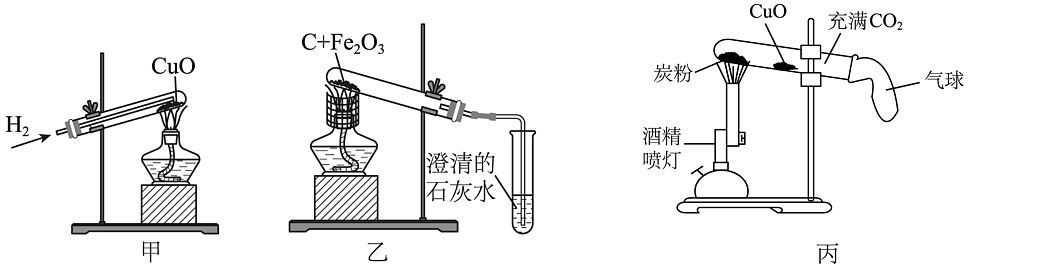 (1)、上述三个金属冶炼的实验中发生的主要反应属于置换反应的是。(填“甲、乙、丙”)(2)、甲实验反应后试管中出现红色固体变成黑色现象的原因。(3)、乙实验的冶炼效果不理想,后采用酒精喷灯代替普通酒精灯重做此实验效果较理想。由此可以推断,原装置冶炼不理想的原因。(4)、写出丙实验中得到金属铜的化学方程式。20. 请同学们根据常见的可溶性碱的性质回答下列问题。
(1)、上述三个金属冶炼的实验中发生的主要反应属于置换反应的是。(填“甲、乙、丙”)(2)、甲实验反应后试管中出现红色固体变成黑色现象的原因。(3)、乙实验的冶炼效果不理想,后采用酒精喷灯代替普通酒精灯重做此实验效果较理想。由此可以推断,原装置冶炼不理想的原因。(4)、写出丙实验中得到金属铜的化学方程式。20. 请同学们根据常见的可溶性碱的性质回答下列问题。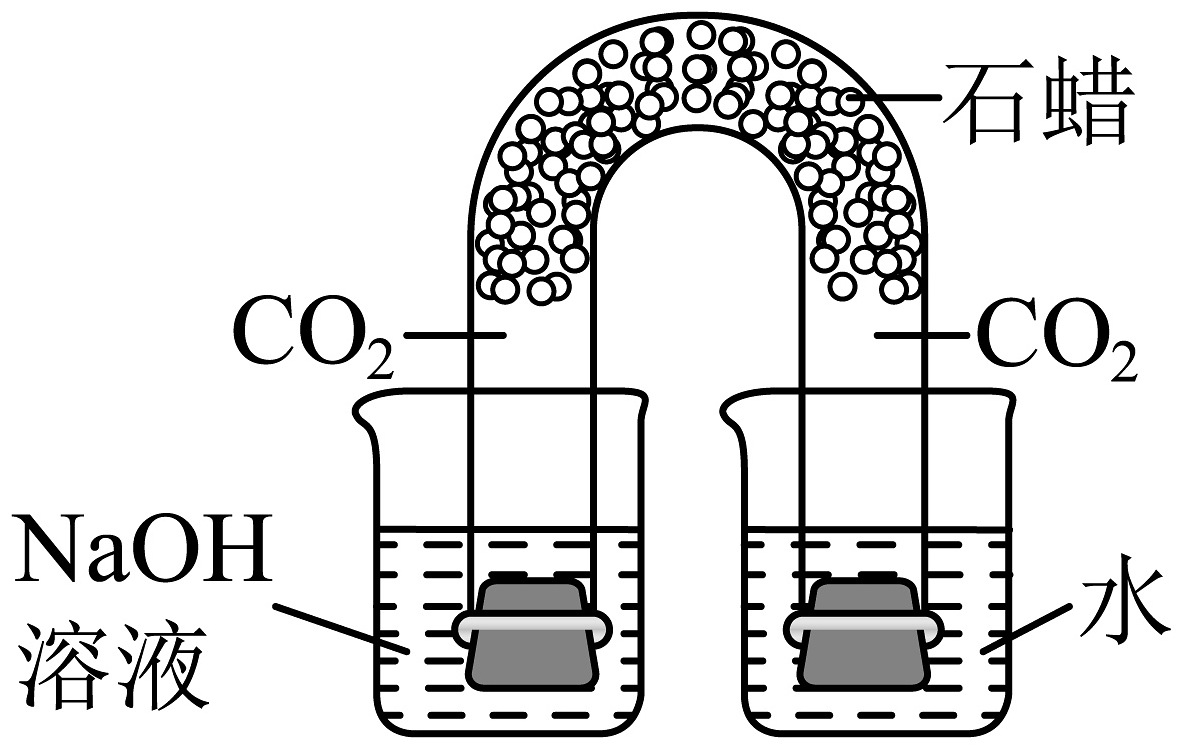 (1)、如图是用U型管改进后的创新实验装置,石蜡使左右两边气体不相通,同时取下U型管两端的橡胶塞2发生反应的证据是。(2)、为验证Ca(OH)2能与某些盐反应且又是碱的通性,可选择的物质是_________(填字母)。A、BaCO3 B、Na2CO3 C、Ba(NO3)2 D、CuSO421. 将金属铜进行如下实验:
(1)、如图是用U型管改进后的创新实验装置,石蜡使左右两边气体不相通,同时取下U型管两端的橡胶塞2发生反应的证据是。(2)、为验证Ca(OH)2能与某些盐反应且又是碱的通性,可选择的物质是_________(填字母)。A、BaCO3 B、Na2CO3 C、Ba(NO3)2 D、CuSO421. 将金属铜进行如下实验: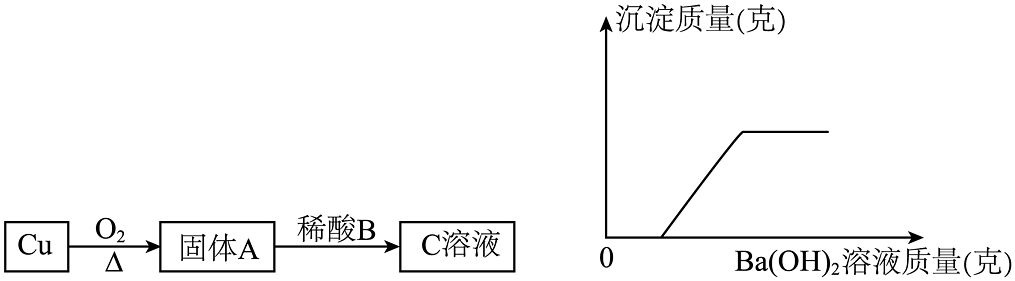
向得到的C溶液中逐滴滴加Ba(OH)2溶液,滴加Ba(OH)2溶液的质量与产生沉淀的质量关系如图所示。请回答:
(1)写出Cu→A的化学方程式
(2 )写出C溶液中溶质的化学式
22. 小金学习了金属活动性内容知识,想利用所学知识解决以下问题。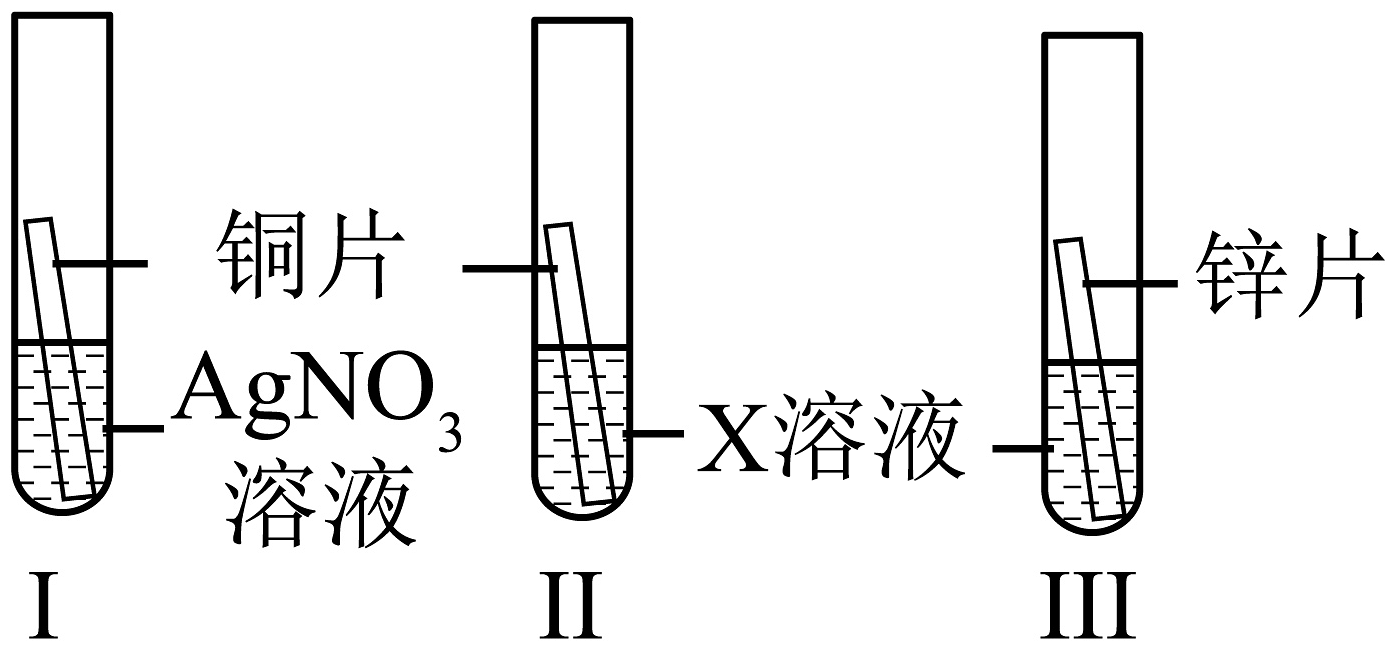 (1)、小金想比较锌、铜、银的金属活动性,进行如图实验。要完成此实验,X溶液可能是。(2)、小金又重新设计实验,只用锌片、铜片和AgNO3溶液,也能比较锌、铜、银的金属活动性,先将放入AgNO3溶液中,充分反应后,再放入另一种金属片。(3)、小金向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定质量的锌,充分反应后过滤,得到滤渣A和滤液B。若反应前后溶液质量不变,滤渣A中一定含有。若反应后溶液质量减少,B中一定含有的金属离子是。
(1)、小金想比较锌、铜、银的金属活动性,进行如图实验。要完成此实验,X溶液可能是。(2)、小金又重新设计实验,只用锌片、铜片和AgNO3溶液,也能比较锌、铜、银的金属活动性,先将放入AgNO3溶液中,充分反应后,再放入另一种金属片。(3)、小金向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定质量的锌,充分反应后过滤,得到滤渣A和滤液B。若反应前后溶液质量不变,滤渣A中一定含有。若反应后溶液质量减少,B中一定含有的金属离子是。三、实验与探究题(每空2分,共40分)
-
23. 某兴趣小组开展利用紫甘蓝制作酸碱指示剂的项目化学习,他们经历了制取试剂、检验试剂和应用试剂三个环节的探索。
【制取试剂】(1)小组制作过程如下图所示,步骤②中加入的酒精的目的是;步骤③中物质分离的原理类似于(填“沉淀”或“过滤”)。

【检验试剂】(2)小科将紫甘蓝汁液滴入4种物质中,现象如下表示所示,下列选项能证明紫甘蓝汁可以作为酸碱指示剂的理想组合。
A.①②③ B.①③④ C.②③④
实验
①
②
③
④
物质
水
食盐水
石灰水
白醋
颜色
紫色
紫色
蓝色
红色
【应用试剂】(3)现有蒸馏水、氢氧化钠和稀硫酸三种试液。可以利用自制的紫甘蓝汁液鉴别出其中的稀硫酸。请写出鉴别稀硫酸的操作步骤和预期现象。。
24. 某科学探究小组对一包固体粉末中的成分进行鉴别,粉末中可能含有中的一种或几种,实验操作步骤及现象如图,试回答:
(1)仅由步骤Ⅰ可知,固体粉末中不可能含有的物质是(填化学式,下同);
(2)白色沉淀A为
(3)无色溶液D一定含有的溶质是
(4)结论:固体粉末中一定含有
A. B.NaOH C.NaCl
25. 2023年杭州亚运会的火炬设计思想源自良渚文化,名为“薪火”,寓意着中华文明薪火相传,丙烷(C3H8)为燃料,为探究其燃烧后的产物,课外实验小组的同学在老师的指导下选择了如图装置对丙烷燃烧后的气体进行了检测。(根据质量守恒定律丙烷燃烧后的气体产物可能含有CO、CO2和H2O) (1)、请写出一条丙烷的化学性质。(2)、燃烧后的气体应依次通过装置(选填“A→C”或“C→A”)→B→D。(3)、实验过程中能观察的现象:A装置中的澄清石灰水变浑浊,B装置中黑色粉末变红,C中的无水硫酸铜变蓝,则丙烷燃烧后的产物是。(4)、A中氢氧化钠溶液的作用是。26. 小乐为了测定某生锈的生铁片中铁元素的质量分数,设计并完成了如下实验:
(1)、请写出一条丙烷的化学性质。(2)、燃烧后的气体应依次通过装置(选填“A→C”或“C→A”)→B→D。(3)、实验过程中能观察的现象:A装置中的澄清石灰水变浑浊,B装置中黑色粉末变红,C中的无水硫酸铜变蓝,则丙烷燃烧后的产物是。(4)、A中氢氧化钠溶液的作用是。26. 小乐为了测定某生锈的生铁片中铁元素的质量分数,设计并完成了如下实验:实验编号及装置
实验步骤
实验现象
①天平
称量生锈的生铁片的质量
生锈的生铁片的质量为m g
②装置甲
先通入一段时间CO,然后加热;完全反应后,停止加热;继续通CO至室温
生锈的生铁片变成光亮的银白色
③装置乙
将②中生成的光亮的银白色铁片放入稀盐酸中,完全反应
试管中——;测得室温下产生氢气的体积为V L

(1)装置甲存在缺陷,其改进方法是。
(2)装置乙试管中观察到的实验现象是。
(3)若室温下氢气的密度为ρ g/L,生锈的生铁片中铁元素的质量分数是(用字母表示)。
(4)有人认为:“②中所得光亮的银白色铁片的质量,即为此生锈的生铁片中铁元素的质量,没有必要进行③的操作”。判断此观点是否正确,并说明理由。。
27. 某兴趣小组的同学来到实验室做实验,向盛有少量NaOH溶液的试管中滴入CO2 , 没看到明显的实验现象,同学们对NaOH与CO2;能否反应通行验证,并对实验后的废液成分进行探究。
【实验1】
(1)取1、2两个相同的充满CO2的矿泉水瓶,分别加入50mL的水和等体积的NaOH溶液。立即拧紧瓶盖,实验如图甲,充分振荡,1、2瓶子变形的程度大的是 。
【实验2】兴趣小组的同学继续进行如下探究。
取软塑料瓶②实验后的液体于三支试管中,三位同学分别完成了如图乙所示实验。
(2)同学们观察到的实验现象是:A试管中有气泡冒出,B、C试管中产生白色沉淀,可证明NaOH与CO2发生了反应。
【实验3】
(3)实验结束后,同学们将三支试管中反应后的剩余物倒入一个洁净的大烧杯中(如图丙),搅拌,静置,观底到烧杯上层是无色溶液,下层有白色沉淀。
请你分析上层溶液中一定没有剩余的物质是 (选项A、B、C)。
A.Na2CO3 B.CaCl2 C.HCl
(4)【提出问题】烧杯内上层溶液中可能含有哪些阴离子?
【进行实验】
实验步骤
实验现象
实验结论
①取烧杯内无色溶液少许于试管中,滴加 溶液。
产生白色沉淀
溶液中有
②取步骤①中反应后的上层清液少许于试管中,滴加CuCl2溶液。
产生蓝色沉淀
溶液中含有 OH﹣
【结论】通过实验,同学们确定烧杯内上层溶液一定存在的阴离子。综合分析,最终确定烧杯内上层溶液一定存在的离子有 (选填A或B或C或D)。
A.、OH﹣、Na+ B.Cl﹣、、OH﹣
C.Na+、Cl﹣、、OH﹣ D.Na+、Cl﹣、Ca2+、、OH﹣
【交流反思】将烧杯内的物质过滤,滤渣回收,向滤液中加入适量的稀盐酸,进行处理后再排放,可以有效防止水体污染。
四、综合题(28题7分,29、30、31题8分,32题4分共35分)
-
28. 常温下,在用稀盐酸和氢氧化钡溶液进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示。
 (1)、根据此变化曲线,你认为实验操作是将滴加到另一种溶液中。(2)、当加入溶液的质量是ag时,滴入无色酚酞溶液,溶液呈红色(写化学式)。(3)、求恰好完全反应时溶液中溶质的质量(需写出计算过程,结果精确到0.1g)。29. 现有一家庭使用纯碱样品,其中含杂质氯化钠(不含其它杂质),为了测定样品中杂质氯化钠的质量分数
(1)、根据此变化曲线,你认为实验操作是将滴加到另一种溶液中。(2)、当加入溶液的质量是ag时,滴入无色酚酞溶液,溶液呈红色(写化学式)。(3)、求恰好完全反应时溶液中溶质的质量(需写出计算过程,结果精确到0.1g)。29. 现有一家庭使用纯碱样品,其中含杂质氯化钠(不含其它杂质),为了测定样品中杂质氯化钠的质量分数编号
第1次
第2次
第3次
所取固体样品的质量/g
15
12
12
加入氯化钙溶液的质量/g
100
100
150
反应后生成沉淀的质量/g
10
10
10
完成下列计算(计算结果精确到0.1%)。
(1)、第次实验中样品与氯化钙恰好完全反应?(2)、加入氯化钙溶液的溶质质量分数。(3)、恰好完全反应时,反应后所得溶液中氯化钠的质量分数。30. 现代炼铁的主要方法是高炉炼铁,从炉顶装入铁矿石、焦炭、石灰石,从位于炉子下部的进风口吹入经预热的空气,经发生系列反应后最终得到生铁(如图所示)。
(1)从出铁口得到的为生铁,(含2%~4.5%的碳),在物质分类上其属于物。
(2)用赤铁矿(Fe2O3)为原料炼铁需要还原剂CO,其来源是以焦炭为原料,经①与②两个化学变化过程,请写出反应②的化学方程式。
(3)某大型高炉年产生铁4×106吨(设生铁的含铁质量分数为98%,在冶炼过程中铁的损耗不计),则需要含氧化铁质量分数为70%的赤铁矿石多少吨?
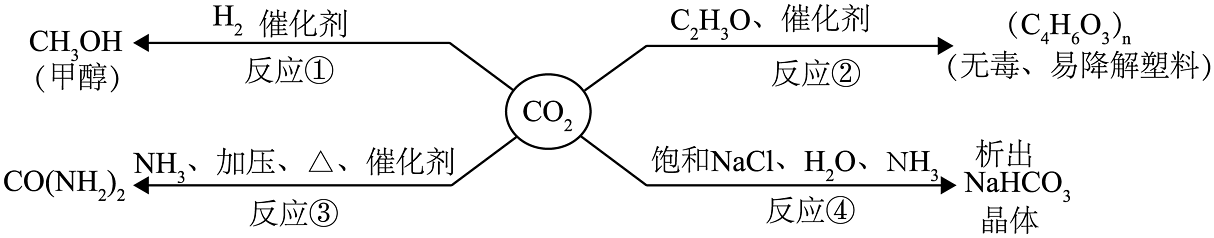
31. 某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,取废水500克,向其中加入溶质质量分数为20%的氢氧化钠溶液。测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示。请回答: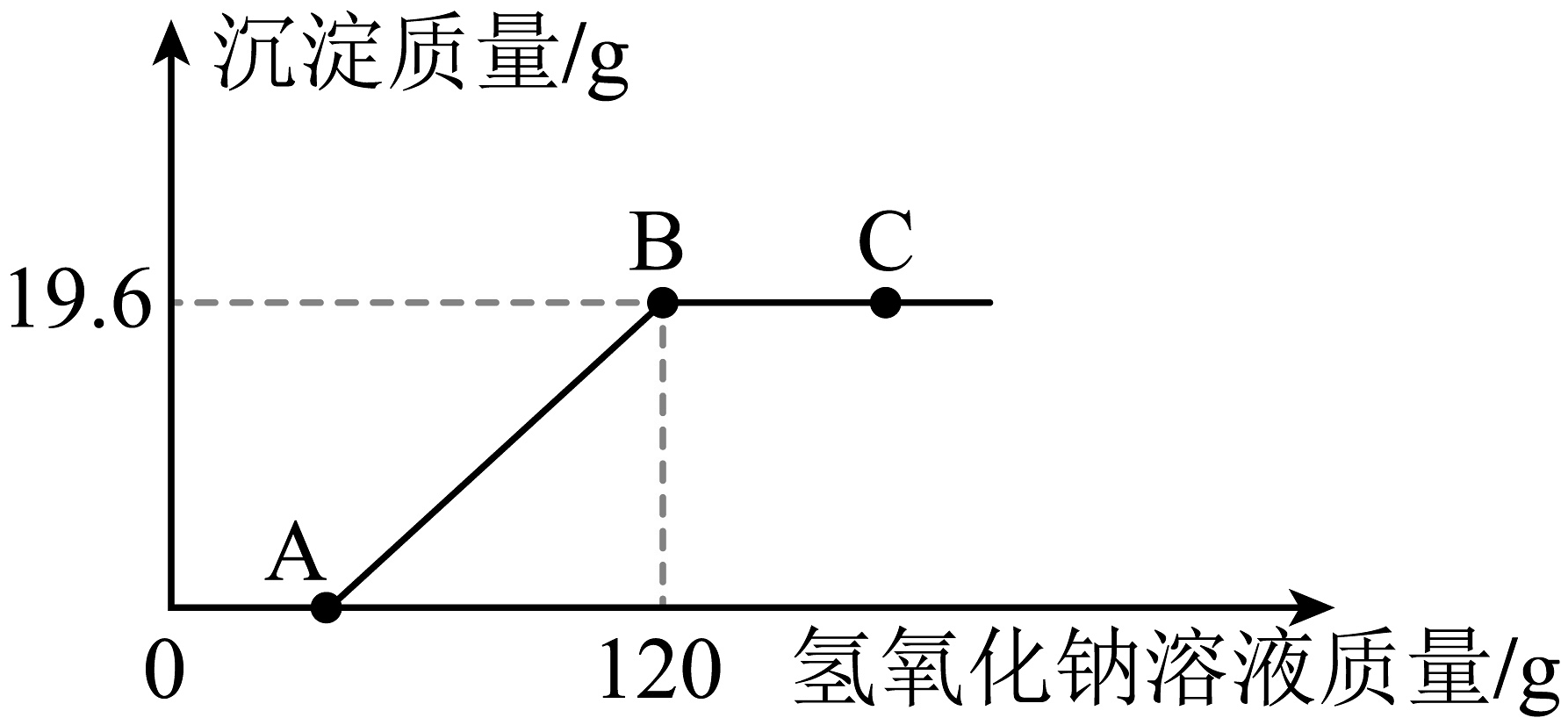 (1)、在C点时,反应后的溶液中含有的溶质有(填化学式)。(2)、500g该废水中硫酸铜的质量为多少?(3)、该废水中硫酸的溶质质量分数为多少?32. CO2是最主要的温室气体,也是巨大的碳资源。CO2的低能牦捕集、转化和利用正受到世界各国的广泛关注。以CO2为原料可获得下列四种物质(如图),反应①中CO2与H2在催化条件下反应生成甲醇和水,写出反应的方程式;反应②的实现有利于缓解温室效应和;反应③可用来制取肥;反应④获得产品后的剩余溶液中,溶质中有过量的反应物和(填化学式)。
(1)、在C点时,反应后的溶液中含有的溶质有(填化学式)。(2)、500g该废水中硫酸铜的质量为多少?(3)、该废水中硫酸的溶质质量分数为多少?32. CO2是最主要的温室气体,也是巨大的碳资源。CO2的低能牦捕集、转化和利用正受到世界各国的广泛关注。以CO2为原料可获得下列四种物质(如图),反应①中CO2与H2在催化条件下反应生成甲醇和水,写出反应的方程式;反应②的实现有利于缓解温室效应和;反应③可用来制取肥;反应④获得产品后的剩余溶液中,溶质中有过量的反应物和(填化学式)。