人教版2017-2018学年第八单元 金属和金属材料 单元测试
试卷更新日期:2017-12-11 类型:单元试卷
一、单选题
-
1. 下列物质中不属于合金的是( )A、玻璃钢 B、黄铜 C、生铁 D、硬铝2. 属于金属的是( )A、Mg B、O2 C、S D、P3. 下列关于金属的说法中,不正确的是( )A、铜有良好的导电性,常用于制作导线 B、所有的金属都能与稀盐酸反应 C、铁制品在干燥的空气中不易生锈 D、不锈钢具有较强的耐腐蚀性,可用于制作医疗器械4. 下列有关金属的说法错误的是( )A、铜能导电 B、银能与稀盐酸反应 C、镁的活动性比铁强 D、铝具有良好的抗腐蚀性5. 在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,充分反应后过滤,滤液仍为蓝色,滤渣中所含物质不可能的情况是( )A、可能有银和铜,没有锌 B、可能只有银,没有铜和锌 C、一定有银,可能有铜和锌 D、一定有银、没有锌,可能有铜6. 下列环境中,铁钉表面最容易产生铁锈的是( )A、在稀盐酸中 B、在潮湿的空气中 C、在干燥的空气中 D、浸没在植物油中7. 向含有硫酸铜的废液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生,有关判断正确的是( )A、滤渣中一定有铁、可能有铜 B、滤渣中一定有铁,没有铜 C、滤液中一定有硫酸亚铁,硫酸铜 D、滤液中一定有硫酸亚铁,没有硫酸铜8. 下列防锈措施不合理的是( )A、钢管存放在干燥的地方 B、用盐水清洗菜刀 C、及时清除铁制品表面的锈渍 D、在铁管表面镀上一层不易锈蚀的金属9. 向AgNO3溶液中加入一定量的Mg粉和Cu粉,充分反应后过滤,得到滤渣和蓝色的滤液.关于该滤渣和滤液有下列四种说法:①向滤渣中加入稀盐酸,可能有气泡产生;②向滤液中加入稀盐酸一定有沉淀产生;③滤渣中一定有Ag;④滤液中一定有Cu(NO3)2、一定不含AgNO3、可能有Mg(NO3)2 , 以上说法中正确的个数为( )A、1个 B、2个 C、3个 D、4个10. 铝、铁、铜三种金属与我们的生活密切相关,下列关于铝、铁、铜的说法错误的是( )A、铝与硫酸铜溶液反应的化学方程式为Al+CuSO4═AlSO4+Cu B、用硫酸铝溶液、氯化铜溶液、单质铁三种物质可探究出三种金属活动性顺序 C、铝制品具有抗腐蚀性,是因为铝制器品表面可形成致密的氧化物薄膜 D、我国历史上最早使用的金属是铜11. 用1000t含有氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量约是( )A、560t B、571t C、577t D、583t
二、多选题
-
12. 将一定质量的Zn加入到Mg(NO3)2、Fe(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,滤液仍为浅绿色,则下列判断正确的是( )A、滤渣一定为Ag、Fe B、向滤液中滴加稀盐酸,可能产生白色沉淀 C、滤液中最多含有三种溶质 D、反应前后金属固体的质量可能不变
三、综合题
-
13. 金属和金属材料在日常生活中有广泛用途.请回答下列问题:(1)、地壳中含量最高的金属元素是(填元素符号).(2)、现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生氢气,乙不反应;如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙表面有银析出,而丙没有变化.根据以上实验事实,判断甲、乙、丙的金属活动性由强到弱的顺序是 .(3)、铜丝浸入硝酸银溶液中,可发生反应:Cu+2AgNO3=Cu( NO3)2+2Ag,该反应属于四种基本反应类型中的反应.14. 人类的生活和生产都离不开金属.铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关.(1)、生活中常用铜做导线,主要是利用了铜的 .(2)、铝制品具有良好抗腐蚀性能的原因是 .(3)、为了验证三种金属的活动性顺序,可选择Al、Cu和下列试剂中的 来达到实验目的.(选填字母序号)A、Al2(SO4)3溶液 B、FeSO4溶液 C、CuSO4溶液(4)、请你写出一条保护金属资源的有效途径 .15. 回答下列与金属有关的问题.(1)、用铜作导线,利用了它的延展性和性;(2)、铝制品表面有一层致密的氧化物薄膜,其化学式为;(3)、向 Cu(NO 3 )2、AgNO 3 和 Mg(NO 3 )2 的混合溶液中加入一定的锌粉,反应停止后过滤,向滤液中插入铁丝,铁丝表面无明显变化,则滤渣中一定含有的金属是 .16. 在一定质量Cu(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入过量的Zn,充分反应后,过滤,可得到固体和溶液.(1)、请写出一个有关反应的化学方程式.(2)、向所得固体上滴加盐酸,能观察到什么现象.(3)、反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么?
四、实验探究题
-
17. 钢铁是使用最多的金属材料.(1)、铁制品锈蚀的过程,实际上是铁跟空气中的发生化学反应的过程;可用稀硫酸除去其表面的铁锈,反应的化学方程式为 .(2)、锰(Mn)钢属于铁合金,可用于制造钢轨.已知锰的金属活动性介于镁与锌之间,如果用实验比较铁和锰的金属活动性强弱,下列所给试剂组能够达到目的是 (填字母序号).A、Fe、Mn、40%硫酸溶液 B、Fe、Mn、MgSO4溶液 C、Fe、Mn、ZnSO4溶液 D、Cu、FeSO4溶液、MnSO4溶液.18. 废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属Cu.实验流程如图所示(部分生成物已略):
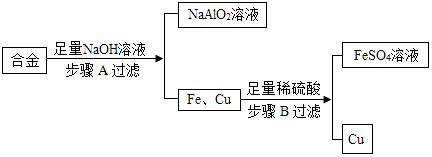 (1)、合金属于(填“纯净物”或“混合物”).(2)、生活中铝比铁更耐腐蚀的原因(用化学反应方程式解释).(3)、步骤A化学反应方程式表示为:2Al+2NaOH+2R═2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为 .(4)、步骤B发生的化学方程式为;反应的基本类型为 .
(1)、合金属于(填“纯净物”或“混合物”).(2)、生活中铝比铁更耐腐蚀的原因(用化学反应方程式解释).(3)、步骤A化学反应方程式表示为:2Al+2NaOH+2R═2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为 .(4)、步骤B发生的化学方程式为;反应的基本类型为 .
-