河南省洛阳市2017-2018学年高三上学期化学期中考试试卷
试卷更新日期:2017-12-08 类型:期中考试
一、选择题
-
1. 许多成语中都蕴含化学原理.下列有关解释不正确的是( )
成语
化学原理
A
炉火纯青
通过观察火焰的颜色来判断炉内的温度
B
刀耕火耨
放火烧去野草,用余灰可以肥田,还可以降低土壤碱性
C
百炼成钢
通过多次锻炼,使生铁中碳等杂质降低达到了钢的标准
D
青出于蓝而胜于蓝
蓝色的靛蓝染料发生化学反应生成一种深蓝色的新染料
A、A B、B C、C D、D2. 下列有关说法正确的是( )A、标准状况下,6.72L NO2与水反应转移的电子数为0.1NA B、1 L 0.1 mol/L的碳酸钠溶液中的阴离子总数等于0.1NA C、1 mol Cl2与足量Fe反应转移电子数一定为3NA D、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA3. 下列说法正确的是( )A、二氧化硫可用于杀菌、消毒 B、煤经过气化和液化等物理变化可转化为清洁能源 C、氯气和明矾均可做自来水的消毒剂 D、食品保鲜剂中所含铁粉和生石灰均作还原剂4. 依据元素周期律进行推断,下列不正确的是( )A、碱性:KOH>NaOH B、氧化性:Cl2>S C、稳定性:HBr>HI D、酸性:H3PO4>HNO35. 下列离子方程式书写正确的是( )A、铁粉溶于氯化铁溶液:Fe+2Fe3+═3Fe2+ B、硫化钠溶液呈碱性:S2﹣+2H2O⇌H2S+OH﹣ C、用FeCl3溶液回收废旧电路板中的Cu:Fe3++Cu═Fe2++Cu2+ D、工业上利用电解饱和食盐制氯气:2H++2Cl﹣ H2↑+Cl2↑6. 下列热化学方程式书写正确的是(△H的绝对值均正确)( )A、C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=﹣1 367.0 kJ•mol﹣1(燃烧热) B、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ•mol﹣1(中和热) C、S(s)+O2(g)═SO2(g);△H=﹣296.8 kJ•mol﹣1(反应热) D、2NO2═O2+2NO;△H=+116.2 kJ•mol﹣1(反应热)7. 硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A、Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存 B、 向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C、检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D、向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
8. 对于下列实验事实的解释,不合理的是( )
向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C、检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D、向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
8. 对于下列实验事实的解释,不合理的是( )选项
实验事实
解释
A
加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体
H2SO4不易挥发,HCl易挥发
B
电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na
得电子能力:Cu2+>Na+>H+
C
浓HNO3能氧化NO;稀HNO3不能氧化NO
HNO3浓度越大,氧化性越强
D
钠与乙醇反应平缓;钠与水反应剧烈
羟基中氢的活性:C2H5OH<H2O
A、A B、B C、C D、D9. 下列实验操作能达到实验目的是( )A、用排水法收集铜粉与浓硝酸反应产生的NO2 B、用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 C、用酸性KMnO4溶液验证草酸的还原性 D、用饱和NaHCO3溶液除去Cl2中混有的HCl10. 下列说法正确的是( )A、SO2和NO2都是酸性氧化物,都能与水反应生成酸 B、Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 C、Al2O3和Na2O按物质的量比1:1投人水中可得到澄清溶液 D、金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气11. 下列有关物质应用的说法错误的是( )A、CCl4曾用作灭火剂,但因与水在高温下反应会产生有毒物质,现已被禁用 B、工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 C、Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质 D、为了延长果实或花朵的成熟期,可用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯12. 短周期元素W、X、Y、Z的原子序数依次增大.W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同.下列说法错误的是( )A、单质的沸点:Z>W B、简单离子半径:X>W C、元素X与氧可形成既含离子键也含非极性共价键的化合物 D、X、Y、Z的最高价氧化物对应的水化物能相互反应13. 用下列装置完成相关实验,合理的是( ) )A、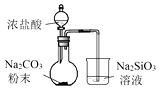 验证H2CO3酸性强于H2SiO3
B、
验证H2CO3酸性强于H2SiO3
B、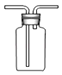 收集CO2或NH3
C、
收集CO2或NH3
C、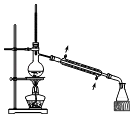 分离Na2CO3溶液与CH3COOC2H5
D、
分离Na2CO3溶液与CH3COOC2H5
D、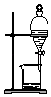 分离CH3CH2OH与CH3COOC2H5
14. 某含Na+的溶液中还可能含有NH4+、Fe3+、Br﹣、CO32﹣、I﹣、SO32﹣ . 取样,滴加足量氯水有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉溶液均无现象.为确定该溶液的组成,还需进行的实验有( )A、取样,滴加硫氰化钾溶液 B、取样,加氯水和CCl4 , 振荡、静置 C、取样,加足量盐酸加热,用湿润的品红试纸检验气体 D、取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体15. 下列图示与对应的叙述相符的是( )A、
分离CH3CH2OH与CH3COOC2H5
14. 某含Na+的溶液中还可能含有NH4+、Fe3+、Br﹣、CO32﹣、I﹣、SO32﹣ . 取样,滴加足量氯水有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉溶液均无现象.为确定该溶液的组成,还需进行的实验有( )A、取样,滴加硫氰化钾溶液 B、取样,加氯水和CCl4 , 振荡、静置 C、取样,加足量盐酸加热,用湿润的品红试纸检验气体 D、取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体15. 下列图示与对应的叙述相符的是( )A、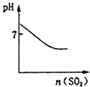 可表示将SO2气体通入溴水时pH的变化
B、
可表示将SO2气体通入溴水时pH的变化
B、 表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C、
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C、 表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D、
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D、 表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
16. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Fe FeCl3 Fe(OH)3 B、S SO3 H2SO4 C、NaOH Na2O Na2SiO3 D、NH3 NO HNO317. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
16. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Fe FeCl3 Fe(OH)3 B、S SO3 H2SO4 C、NaOH Na2O Na2SiO3 D、NH3 NO HNO317. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓盐酸
Na2SO3
SO2
NaOH溶液
C
浓硝酸
Cu
NO2
NaOH溶液
D
浓盐酸
MnO2
Cl2
NaOH溶液
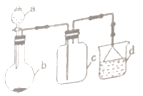 A、A B、B C、C D、D18. 下列关于0.5mol•L﹣1NaHCO3溶液的说法正确的是( )A、溶质的电离方程式为NaHCO3=Na++H++CO32﹣ B、加水稀释后,n(H+)与n(OH﹣)的乘积变大 C、离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣) D、温度升高,c(HCO3﹣)增大19. 在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:
A、A B、B C、C D、D18. 下列关于0.5mol•L﹣1NaHCO3溶液的说法正确的是( )A、溶质的电离方程式为NaHCO3=Na++H++CO32﹣ B、加水稀释后,n(H+)与n(OH﹣)的乘积变大 C、离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣) D、温度升高,c(HCO3﹣)增大19. 在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:物质
X
Y
Z
初始浓度/mol•L﹣1
0.1
0.2
0
平衡浓度/mol•L﹣1
0.05
0.05
0.1
下列说法错误的是( )
A、反应达到平衡时,X的转化率为50% B、反应可表示为X+3Y⇌2Z,其平衡常数为1600 C、增大压强使平衡向生成Z的方向移动,平衡常数增大 D、改变温度可以改变此反应的平衡常数20. 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O.下列说法不正确的是( )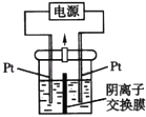 A、右侧发生的电极方程式:2H2O+2e﹣=H2↑+2OH﹣ B、电解结束时,右侧溶液中含有IO3﹣ C、电解槽内发生反应的总化学方程式KI+3H2O KIO3+3H2↑ D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
A、右侧发生的电极方程式:2H2O+2e﹣=H2↑+2OH﹣ B、电解结束时,右侧溶液中含有IO3﹣ C、电解槽内发生反应的总化学方程式KI+3H2O KIO3+3H2↑ D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变二、填空题
-
21. X、Y、L、M为核电荷数依次增大的前20号主族元素.X的原子半径最小,Y、L与M三种元素的质子数均为5的倍数.回答下列问题:(1)、X与Y组成的化合物属于(填“共价”或“离子”)化合物.(2)、X与M组成的物质电子式为 , 该物质可作为野外工作的应急燃料,其与水反应的化学方程式为 .(3)、Y在周期表中的位置是 , 其含氧酸的化学式为 .(4)、下列说法正确的是 .A、L可能是Ne,也可能是P B、L在氯气中燃烧现象为白色烟雾 C、L与X形成的化合物分子构型为平面三角形 D、L有多种氧化物以及含氧酸.22. 亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去).
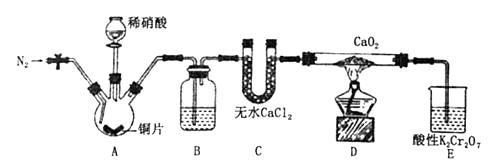
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2 .
请回答下列问题:
a.向装置中通入N2 b.向三颈烧瓶中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入氮气 f.关闭分液漏斗旋塞
(1)、上述操作的正确排序为、c、、f、、 .(2)、B中盛放的试剂是 , 作用是除去(填化学式).(3)、装置E中,酸性K2Cr2O7溶液的作用:可将剩余的NO氧化成NO ,溶液由橙色变为绿色(Cr3+),反应的离子方程式是 .(4)、已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体.设计实验证明D中有亚硝酸钙生成 .(5)、整个过程持续通入氮气的作用 .23. 水中的溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化、滴定
在碘量瓶中将因氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+(该反应放热),在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2═2I﹣+S4O )
回答下列问题:
(1)、“氧的固定”中发生反应的化学方程式为 .(2)、水样酸化后发生反应的离子方程式 .(3)、在碘量瓶(如图)中进行反应,要盖上塞子且在塞子上倒少量水,这样做的目的是 . (4)、Na2S2O3溶液不稳定,易被氧化,且易受到水中CO2以及微生物的影响而分解,配制该溶液时需要的蒸馏水必须经过煮沸、冷却后才能使用,其目的是 .(5)、Na2S2O3溶液不稳定,使用前需标定,KIO3做其准物标定Na2S2O3溶液的浓度,称取0.214g KIO3与过量的KI作用,析出的碘用Na2S2O3溶液滴定,用去24.00mL,此Na2S2O3溶液的浓度为(已知M(KIO3)=214.0g•mol﹣1)(6)、取100.00mL 水样经固氧、酸化后,用该 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;若消耗Na2S2O3溶液的体积为10mL,则水样中溶解氧的含量为mg•L﹣1 .24. 以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4•H2O的过程如图所示:
(4)、Na2S2O3溶液不稳定,易被氧化,且易受到水中CO2以及微生物的影响而分解,配制该溶液时需要的蒸馏水必须经过煮沸、冷却后才能使用,其目的是 .(5)、Na2S2O3溶液不稳定,使用前需标定,KIO3做其准物标定Na2S2O3溶液的浓度,称取0.214g KIO3与过量的KI作用,析出的碘用Na2S2O3溶液滴定,用去24.00mL,此Na2S2O3溶液的浓度为(已知M(KIO3)=214.0g•mol﹣1)(6)、取100.00mL 水样经固氧、酸化后,用该 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;若消耗Na2S2O3溶液的体积为10mL,则水样中溶解氧的含量为mg•L﹣1 .24. 以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4•H2O的过程如图所示: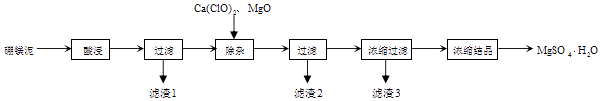
硼镁泥的主要成分如表:
MgO
SiO2
FeO、Fe2O3
CaO
Al2O3
B2O3
30%~40%
20%~25%
5%~15%
2%~3%
1%~2%
1%~2%
资料:B2O3溶于水形成硼酸,由于硼酸易溶于水,溶解度随温度的升高而升高,而硫酸镁在80℃溶解度最大,所以常规方法很难将二者分离,目前常采用高温结晶法
回答下列问题:
(1)、“滤渣1”中主要含有(写化学式)(2)、“滤渣2”中主要含有(写化学式),判断“除杂”基本完成的检验方法正确的是 .A.取上层清液,滴加苯酚试液不显紫色
B.取上层清液,滴加KSCN,不变红
C.取上层清液,滴加K3[Fe(CN)6]不产生蓝色沉淀
(3)、氧化镁的作用是 . 有同学认为用碳酸镁比用氧化镁要好,原因是 .(4)、分离滤渣3应趁热过滤的原因是 . 分离滤渣3后的母液中含有的溶质是和 , 可以采用加压、的方法得到一水合硫酸镁.