安徽省淮北市濉溪县2017-2018学年高二上学期化学期中考试试卷
试卷更新日期:2017-12-08 类型:期中考试
一、选择题
-
1. 下列“化学与生活”的说法不正确的是( )A、硫酸钡可用钡餐透视 B、盐卤可用于制豆腐 C、明矾可用于水的消毒,杀菌 D、醋可用于除去暖水瓶中的水垢2. 下列变化不属于化学变化的是( )A、在稀盐酸中滴入石蕊试液溶液变红 B、少量胆矾粉末加入到浓硫酸中固体变白色 C、SO2通入品红中溶液变为无色 D、红糖水中加入活性炭溶液变为无色3. 设NA为阿伏加德罗常数,下列说法正确的是( )A、标准状况下,22.4L H2O所含的分子数为NA B、由CO2和O2组成的混合物共有NA个分子,其中的氧原子数为2NA C、0.5 mol•L﹣1的Ba(OH)2溶液中OH﹣的数目为NA D、1molNa2O2与足量的CO2反应转移2NA个电子4. NaOH溶液滴定盐酸实验中,不必用到的是( )A、酚酞 B、圆底烧杯 C、锥形瓶 D、碱式滴定管5. 下列热化学方程式中,正确的是( )A、甲烷的燃烧热为890.3 kJ•mol﹣1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3 kJ•mol﹣1 B、101 kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ•mol﹣1 C、HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ•mol﹣1 D、500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=﹣38.6 kJ•mol﹣16. 某公司设计的用于驱动潜艇的液氨﹣液氧燃料电池示意图如下,有关说法正确的是( )
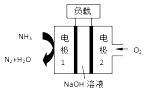 A、电池总反应为:4NH3+3O2=2N2+6H2O B、电池工作时,OH﹣向正极移动 C、电极 2 发生的电极反应为:O2+4H++4e﹣=2H2O D、电流由电极 1 经外电路流向电极27. 等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )A、Na2CO3溶液 B、Na2SiO3溶液 C、NaOH溶液 D、NaHSO3溶液、8. 下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )A、FeCl3 B、Cu(NO3)2 C、Na2SO3 D、NaAlO29. 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
A、电池总反应为:4NH3+3O2=2N2+6H2O B、电池工作时,OH﹣向正极移动 C、电极 2 发生的电极反应为:O2+4H++4e﹣=2H2O D、电流由电极 1 经外电路流向电极27. 等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )A、Na2CO3溶液 B、Na2SiO3溶液 C、NaOH溶液 D、NaHSO3溶液、8. 下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )A、FeCl3 B、Cu(NO3)2 C、Na2SO3 D、NaAlO29. 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( ) A、a电极的电极材料是铜 B、如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 C、锌与稀硫酸反应时放出的热量对实验测定不产生影响 D、若量筒中收集到a L H2 , 则电解质溶液中通过了 mol电子10. 把下列四种X溶液分别加入四个盛有10mL 2mol•L﹣1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸发生反应,其中反应速率最快的是( )A、10℃20mL3mol•L﹣1的X溶液 B、20℃30mL2mol•L﹣1的X溶液 C、20℃10mL4mol•L﹣1的X溶液 D、10℃10mL2mol•L﹣1的X溶液11. 下列关于化工生产原理的叙述中,符合当前工业生产实际的是( )A、氯碱工业中,氢氧化钠在电解槽的阳极区产生 B、硫酸工业中,二氧化硫催化氧化使用催化剂,可增加二氧化硫的转化率 C、合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可提高氨的产率 D、接触法制硫酸中三氧化硫用水吸收制成浓硫酸12. 下列各组离子在指定溶液中一定能大量共存的是( )A、能使酚酞试液变红的溶液中:Na+、Cl﹣、CO32﹣、AlO2﹣ B、在酸性溶液中:Fe2+、Na+、NO3﹣、Cl﹣ C、加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+ D、澄清透明溶液中:K+、Fe3+、SO42﹣、SCN﹣13. 已知反应①:CO(g)+CuO(s)⇌CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)⇌Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )A、反应①的平衡常数K1= B、反应③的平衡常数K= C、对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 D、对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小14. 一定温度下,水存在H2O⇌H++OH﹣△H>0的平衡,下列叙述一定正确的是( )A、向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 B、将水加热,Kw增大,pH减小 C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D、向水中加入少量固体硫酸钠,c(H+)=10﹣7 mol•L﹣1 , Kw不变15. 下列各选项所描述的两个量中,前者一定大于后者的是( )A、CH3COONa溶液中CH3COO﹣和Na+的数目 B、纯水在80℃和25℃时的pH C、相同温度下,100mL0.01mol•L﹣1醋酸与10mL0.1mol•L﹣1醋酸中H+的物质的量 D、相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH﹣)16. 下列有关叙述正确的是( )A、常温下,某溶液中水电离出来的c(H+)和c(OH﹣)的乘积为1×10﹣24 , 该溶液中一定可以大量存在K+、Na+、ClO﹣、SO42﹣ B、对N2(g)+3H2(g)⇌2NH3(g),恒温恒容时充入N2 , 正反速率增大,逆反应速率减小 C、已知25℃时,Ksp(AgCl)=1.8×10﹣10 , 则在0.1mol﹣1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10﹣10mol•L﹣1 D、在酸碱中和滴定时,装标准液的滴定管未用标准液润洗直接装入标准液进行滴定,会引起测定结果浓度偏低17. 三种难溶金属硫化物的溶度积常数(25℃):
A、a电极的电极材料是铜 B、如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 C、锌与稀硫酸反应时放出的热量对实验测定不产生影响 D、若量筒中收集到a L H2 , 则电解质溶液中通过了 mol电子10. 把下列四种X溶液分别加入四个盛有10mL 2mol•L﹣1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸发生反应,其中反应速率最快的是( )A、10℃20mL3mol•L﹣1的X溶液 B、20℃30mL2mol•L﹣1的X溶液 C、20℃10mL4mol•L﹣1的X溶液 D、10℃10mL2mol•L﹣1的X溶液11. 下列关于化工生产原理的叙述中,符合当前工业生产实际的是( )A、氯碱工业中,氢氧化钠在电解槽的阳极区产生 B、硫酸工业中,二氧化硫催化氧化使用催化剂,可增加二氧化硫的转化率 C、合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可提高氨的产率 D、接触法制硫酸中三氧化硫用水吸收制成浓硫酸12. 下列各组离子在指定溶液中一定能大量共存的是( )A、能使酚酞试液变红的溶液中:Na+、Cl﹣、CO32﹣、AlO2﹣ B、在酸性溶液中:Fe2+、Na+、NO3﹣、Cl﹣ C、加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+ D、澄清透明溶液中:K+、Fe3+、SO42﹣、SCN﹣13. 已知反应①:CO(g)+CuO(s)⇌CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)⇌Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )A、反应①的平衡常数K1= B、反应③的平衡常数K= C、对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 D、对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小14. 一定温度下,水存在H2O⇌H++OH﹣△H>0的平衡,下列叙述一定正确的是( )A、向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 B、将水加热,Kw增大,pH减小 C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D、向水中加入少量固体硫酸钠,c(H+)=10﹣7 mol•L﹣1 , Kw不变15. 下列各选项所描述的两个量中,前者一定大于后者的是( )A、CH3COONa溶液中CH3COO﹣和Na+的数目 B、纯水在80℃和25℃时的pH C、相同温度下,100mL0.01mol•L﹣1醋酸与10mL0.1mol•L﹣1醋酸中H+的物质的量 D、相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH﹣)16. 下列有关叙述正确的是( )A、常温下,某溶液中水电离出来的c(H+)和c(OH﹣)的乘积为1×10﹣24 , 该溶液中一定可以大量存在K+、Na+、ClO﹣、SO42﹣ B、对N2(g)+3H2(g)⇌2NH3(g),恒温恒容时充入N2 , 正反速率增大,逆反应速率减小 C、已知25℃时,Ksp(AgCl)=1.8×10﹣10 , 则在0.1mol﹣1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10﹣10mol•L﹣1 D、在酸碱中和滴定时,装标准液的滴定管未用标准液润洗直接装入标准液进行滴定,会引起测定结果浓度偏低17. 三种难溶金属硫化物的溶度积常数(25℃):化学式
FeS
CuS
MnS
溶度积
6.3×10﹣18
1.3×10﹣36
2.5×10﹣13
下列有关说法中正确的是( )
A、25℃时,CuS的溶解度大于MnS的溶解度 B、25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 mol•L﹣1 C、因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 D、除去某溶液中的Cu2+ , 可以选用FeS作沉淀剂18. 已知常温下:某NaHSO3溶液的pH=5,则在NaHSO3溶液中微粒的物质的量浓度关系一定正确的是( )A、c(Na+)>c(HSO3﹣)>c(OH﹣)>c(H+)>(SO32﹣) B、c(Na+)+c(H+)=c(OH﹣)+c(SO32﹣)+c(HSO3﹣) C、c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3) D、c(OH﹣)=c(H+)+c(HSO3﹣)+c(H2SO3)二、填空题
-
19. 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L﹣1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
请回答下列问题:
(1)、滴定时,盛装待测NaOH溶液的仪器名称为 .(2)、盛装标准盐酸的仪器名称为 .(3)、滴定至终点的颜色变化为 .(4)、若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 .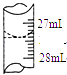 (5)、乙学生做了三组平行实验,数据记录如下:
(5)、乙学生做了三组平行实验,数据记录如下:选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字).
实验序号
待测NaOH溶液的体积/mL
0.1000mol•L﹣1HCl溶液的体积/mL
滴定前刻度
滴定后刻度
①
25.00
0.00
26.29
②
25.00
1.00
31.00
③
25.00
1.00
27.31
(6)、下列哪些操作会使测定结果偏高 (填序号).A、锥形瓶用蒸馏水洗净后再用待测液润洗 B、酸式滴定管用蒸馏水洗净后再用标准液润洗 C、滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失 D、滴定前读数正确,滴定后俯视滴定管读数.20. 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: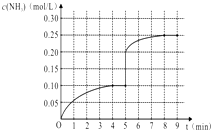 (1)、该反应的化学平衡常数表达式为;(2)、根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= .(3)、该反应达到平衡状态的标志是(填字母);
(1)、该反应的化学平衡常数表达式为;(2)、根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= .(3)、该反应达到平衡状态的标志是(填字母);a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
(4)、在第5分钟末改变某一条件后,在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),达到新平衡时NH3浓度的变化曲线如上图.则第5分钟末改变的条件是 .21. 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题: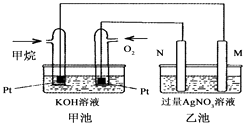 (1)、M电极的材料是 , 其电极反应式为:N的电极名称是 , 电极反应式为:(2)、通入甲烷的铂电极的电极反应式为 .(3)、在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下).22. 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.(1)、有关上述常数的说法正确的是 .
(1)、M电极的材料是 , 其电极反应式为:N的电极名称是 , 电极反应式为:(2)、通入甲烷的铂电极的电极反应式为 .(3)、在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下).22. 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.(1)、有关上述常数的说法正确的是 .a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)、25℃时将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=(3)、已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为(4)、25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2mol•L﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1mol•L﹣1的NaHSO3溶液中c(H2SO3)= .(5)、已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)