备考2018年高考化学一轮基础复习:专题15 元素周期表和元素周期律
试卷更新日期:2017-12-07 类型:一轮复习
一、单选题
-
1. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A、左下方区域的金属元素 B、右上方区域的非金属元素 C、金属元素和非金属元素分界线附近的元素 D、稀有气体元素2. 下列各组元素性质的递变情况错误的是( )A、Li、Be、B原子的最外层电子数依次增多 B、P、S、Cl元素的最高正价依次升高 C、N、O、F元素的电负性依次增大 D、Na、K、Rb元素的第一电离能依次增大3. 下列判断错误的是( )A、沸点:NH3>PH3>AsH3 B、稳定性:HF>HCl>HBr>HI C、酸性:HClO4>H2SO4>H3PO4 D、碱性:NaOH>Mg(OH)2>Al(OH)34. 下列各组性质比较中,正确的是( )
①沸点:HF>HCl>HBr>HI
②离子还原性:S2﹣>Cl﹣>Br﹣>I﹣
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2﹣>F﹣>Na+>Mg2+ .
A、①②③ B、③④⑤⑥ C、②③④ D、①③④⑤⑥5. 下列参数比较及解释均正确的是( )选项
参数
比较
解释
A
沸点
HF<HCl<HI
组成结构相似的物质,相对分子质量越大沸点越高
B
半径
Na+>Al3+>S2﹣
同一周期粒子半径随原子序数的递增逐渐减小
C
酸性
H2SO3>H2CO3
元素的非金属性越强,其含氧酸的酸性越强
D
还原性
P3﹣>S2﹣>Cl﹣
元素的非金属性越强,简单阴离子的还原性越弱
A、A B、B C、C D、D6. 下列说法正确的是( )A、随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强 B、第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性 C、第三周期气态氢化物的沸点均为同主族中沸点最低 D、第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大7. R、M、T、G、J为原子序数依次递增的同一周期主族元素,下列说法一定正确的是(m、n均为正整数)( )A、若HnJOm为强酸,则G一定是位于ⅤA族以后的活泼非金属元素 B、若M(OH)n+1为强碱,则R(OH)n也为强碱 C、若T的最低化合价为﹣3,则J的最高正化合价为+7 D、若M的最高正化合价为+4,则五种元素都是非金属元素8. A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )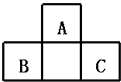 A、Be、Na、Al B、B、Mg、Si C、O、P、Cl D、C、Al、P
A、Be、Na、Al B、B、Mg、Si C、O、P、Cl D、C、Al、P二、填空题
-
9. 原子序数大于4的主族元素A和B的离子分别为Am+和Bn﹣ , 已知它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为(填具体数字) .
②A和B的核电荷数之差为(用含m或n的式子表示)
③B和A的族序数之差为 .
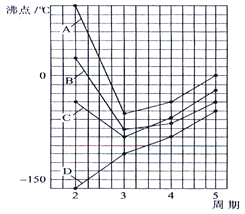
10.如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是 , , , , 同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a . 曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b
 11.
11.Ⅰ.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的某性质)

将上面有关元素性质的曲线标号填入相应元素性质后面的括号中:
(1)ⅡA族元素的最外层电子数
(2)第三周期元素的最高化合价
(3)第三周期离子Na+、Mg2+、Al3+、P3﹣、S2﹣、Cl﹣的离子半径
(4)第二、三周期元素随原子序数递增原子半径的变化(不包括惰性气体)
(5)碱金属的阳离子氧化能力(不包括钫)
Ⅱ.如图是元素周期表的一部分
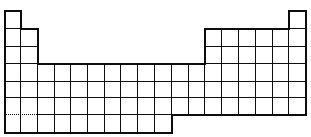
(1)请在表中画出金属与非金属的交界线
(2)请在表中用阴影标出第 VIII族的位置
(3)在表中标出Ti的位置.
三、综合题
-
12. 下表列出了A﹣R9种元素在周期表中的位置:
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
E
F
3
A
C
D
G
R
4
B
H
(1)、这9种元素中,化学性质最不活泼的是 . 最活泼的是 .(2)、D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是 .(3)、A、B、C三种元素按原子半径由大到小的顺序排列为;(4)、F元素氢化物的化学式是 , 所得溶液的pH值;(5)、G元素和H元素两者核电荷数之差是 .13. 某同学设计如图装置,研究非金属元素性质变化规律.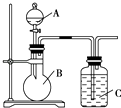 (1)、已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3 .
(1)、已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3 .A中装试剂 , B中装试剂 , C中装试剂 .
(2)、写出C中反应的离子方程式 .14. A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等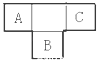 (1)、写出元素的符号:A、B、C;(2)、B元素位于元素周期表中第周期,第族.(3)、C的原子结构示意图为 , 用电子式表示C的单质与H2反应的过程: .(4)、由元素A、C及氢元素形成的化合物中含有的化学键的类型有 .
(1)、写出元素的符号:A、B、C;(2)、B元素位于元素周期表中第周期,第族.(3)、C的原子结构示意图为 , 用电子式表示C的单质与H2反应的过程: .(4)、由元素A、C及氢元素形成的化合物中含有的化学键的类型有 .