备考2018年高考化学一轮基础复习:专题13 含氮化合物
试卷更新日期:2017-12-06 类型:一轮复习
一、单选题
-
1. 下列有关浓硝酸的说法中错误的是( )A、浓HNO3能与碳反应,说明其具有强氧化性 B、浓HNO3能溶解金属铜,说明其具有强酸性 C、浓HNO3不稳定易分解,需要避光保存 D、常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO32. 常温下能共存,且能用浓H2SO4干燥的一组气体是( )A、O2、SO2 B、NH3、N2 C、NO、O2 D、NH3、HCl3. 取四张湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加69%的硝酸、98.3%的硫酸、新制氯水、浓氨水,四张试纸最后呈现的颜色是( )A、白、红、白、蓝 B、白、白、白、蓝 C、白、黑、白、蓝 D、红、黑、红、蓝4. 将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述不正确的是( )A、反应速率:前者快,后者慢 B、消耗硝酸的物质的量:前者多,后者少 C、反应生成相同条件下气体的体积:前者多,后者少 D、反应中转移的电子总数:前者多,后者少5. 下列反应中,硝酸只表现氧化性的是( )A、3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O B、C+4HNO3(浓) CO2↑+4NO2↑+2H2O C、Al(OH)3+3HNO3═Al(NO3)3+3H2O D、3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O6. 将Cu、Zn混合物投入稀HNO3中,充分反应后,锌有剩余,则反应后的溶液中肯定不存在的是
①Cu ②Cu(NO3)2③HNO3④Zn(NO3)2( )
A、①和② B、②和③ C、①和③ D、②和④7. 向铁和铜的混合物中加入一定量的稀硫酸,反应后剩余了m1克金属,再继续加入一定量的硝酸钠溶液后剩余了m2克金属,则m1和 m2的大小关系正确的是( )A、m1=m2 B、m1>m2 C、m1<m2 D、m1≥m28. 通过一步反应不能直接完成的是( )①N2→NO2②S→SO2 ③NH3→NO④NO→HNO3⑤CuSO4→Cu(NO3)2⑥SiO2→H2SiO3 .
A、①⑥ B、④⑤ C、①④ D、⑤⑥9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Fe FeCl2 Fe(OH)2 B、S SO3 H2SO4 C、CaCO3 CaO CaSiO3 D、NH3 NO HNO310.下述实验中均有红棕色气体产生,对比分析所的结论不正确的是( )
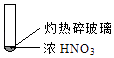
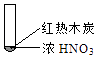
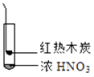
①
②
③
A、由①中的红棕色气体,推断产生的气体一定是混合气体 B、红棕色气体不能表明②中木炭与浓硝酸产生了反应 C、由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 D、③的气体产物中检测出CO2 , 由此说明木炭一定与浓硝酸发生了反应二、填空题
-
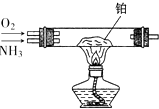
11. 用图所示装置,加热铂丝一段时间后,通入NH3和O2 , 写出该装置硬质玻璃管中发生氨的催化氧化反应的化学方程式 , 并且要求用双线桥标明电子转移的方向与数目:
.
 12. 工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用水稀释.
12. 工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用水稀释.(1)写出Cu与稀硝酸反应的离子方程式: .
(2)等质量的铜分别与足量浓硝酸、稀硝酸完全反应时,还原产物物质的量之比 .
(3)铜和某浓度的硝酸反应,生成等体积的NO和NO2气体,写出反应的化学方程式
13. 利用如图所示的装置收集以下4种气体:①NO2;②NH3;③NO;④SO2 .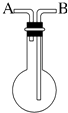 (1)、若烧瓶是干燥的,则由B口进气,可收集的气体有 , 若由A口进气,可收集的气体有 .(2)、若在烧瓶内充满水,可收集的气体有 , 气体应由口进入.(3)、若烧瓶中装入适量浓硫酸,不能被干燥的气体有 , 气体应由口进入.(4)、在标准状况下,将NO气体充满干燥烧瓶,把烧瓶倒置于水中,再向瓶内慢慢通入O2 , 瓶内液面变化情况是 , 假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为 mol•L﹣1 .14. 制取氨气并完成喷泉实验(图中夹持装置均已略去).
(1)、若烧瓶是干燥的,则由B口进气,可收集的气体有 , 若由A口进气,可收集的气体有 .(2)、若在烧瓶内充满水,可收集的气体有 , 气体应由口进入.(3)、若烧瓶中装入适量浓硫酸,不能被干燥的气体有 , 气体应由口进入.(4)、在标准状况下,将NO气体充满干燥烧瓶,把烧瓶倒置于水中,再向瓶内慢慢通入O2 , 瓶内液面变化情况是 , 假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为 mol•L﹣1 .14. 制取氨气并完成喷泉实验(图中夹持装置均已略去). (1)、写出实验室制取氨气的化学方程式 .(2)、收集氨气应使用法,要得到干燥的氨气可选用作干燥剂.(3)、用图Ⅰ所示装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发喷泉的操作是 , 该实验的原理是 .(4)、如果只提供如图Ⅱ所示装置,请说明引发喷泉的方法是(5)、写出氨气催化氧化的化学方程式: .15. 以下是氮循环的一部分:
(1)、写出实验室制取氨气的化学方程式 .(2)、收集氨气应使用法,要得到干燥的氨气可选用作干燥剂.(3)、用图Ⅰ所示装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发喷泉的操作是 , 该实验的原理是 .(4)、如果只提供如图Ⅱ所示装置,请说明引发喷泉的方法是(5)、写出氨气催化氧化的化学方程式: .15. 以下是氮循环的一部分: (1)、通常状况下,NO2的颜色是;(2)、反应①的化学方程式是;(3)、NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;(4)、化合物A的化学式是;(5)、治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.16. 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:(1)、NO的体积为 L,NO2的体积为 L.(2)、将产生的气体全全释放后,向溶液中加入VmLamol•L﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为 mol•L﹣1 .(3)、若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为 mol•L﹣1 .
(1)、通常状况下,NO2的颜色是;(2)、反应①的化学方程式是;(3)、NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;(4)、化合物A的化学式是;(5)、治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.16. 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:(1)、NO的体积为 L,NO2的体积为 L.(2)、将产生的气体全全释放后,向溶液中加入VmLamol•L﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为 mol•L﹣1 .(3)、若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为 mol•L﹣1 .三、实验探究题
-
17. 如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
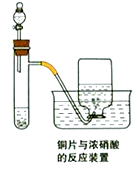 (1)、写出试管内发生反应的化学方程式;(2)、描述在实验过程中观察到的颜色变化:
(1)、写出试管内发生反应的化学方程式;(2)、描述在实验过程中观察到的颜色变化:试管内液体呈色;试管内液体上方气体呈色;集气瓶内收集到的气体呈色.
(3)、在反应一段时间后,从分液漏斗处向试管内加入蒸馏水,请描述加水后试管内和集气瓶内颜色的变化情况:试管内液体呈色;试管内液体上方气体呈色.18. 如图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式.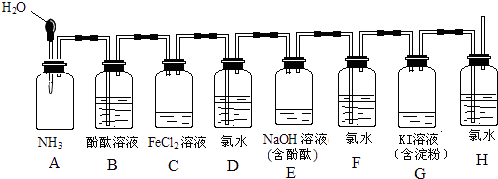 (1)、A中的现象为 , 化学方程式 .(2)、C中的现象为 , 离子方程式 .(3)、E中的现象为 , 离子方程式 .(4)、G中的现象为 , 离子方程式 .19. 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
(1)、A中的现象为 , 化学方程式 .(2)、C中的现象为 , 离子方程式 .(3)、E中的现象为 , 离子方程式 .(4)、G中的现象为 , 离子方程式 .19. 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.请回答下列问题:
 (1)、加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .(2)、关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.(3)、读取量气管读数时,要先 , 然后再读取读数.(4)、数据分析:①从B中取20mL溶液,恰好中和用去0.1mol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 .
(1)、加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .(2)、关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.(3)、读取量气管读数时,要先 , 然后再读取读数.(4)、数据分析:①从B中取20mL溶液,恰好中和用去0.1mol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 .②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为 .
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.