备考2018年高考化学一轮基础复习:专题12 氧、硫及其化合物
试卷更新日期:2017-12-06 类型:一轮复习
一、单选题
-
1. 下列说法不正确的是( )
A、二氧化碳是酸雨的主要成分 B、氢气是一种理想的清洁燃料 C、碳酸氢钠可用于治疗胃酸过多 D、氯化铁溶液可用于制作印刷铜电路板2. 由同一种元素所构成的不同单质被称为同素异形体,下列哪组物质不属于同素异形体的是( )A、钢和铁 B、金刚石和石墨 C、红磷和白磷 D、氧气和臭氧3. 雷雨天闪电时空气中有臭氧(O3)生成,下列说法中不正确的是( )A、O2和O3互为同素异形体 B、O3是由3个氧原子构成的化合物 C、O2和O3相互转化属于化学变化 D、O3的摩尔质量为48g.mol﹣14. 下列变化中,体现浓硫酸的脱水性和强氧化性的是( )A、盛装浓硫酸的烧杯敞口放置一段时间后质量增加 B、把铜片放入浓硫酸中并加热有气体产生 C、常温下可用铁、铝容器盛装浓硫酸 D、向蔗糖中加入浓硫酸,蔗糖变黑膨胀并有刺激性气味的气体放出5. 下列关于S、SO2、H2SO4的叙述中,正确的是( )A、硫是一种易溶于水的黄色晶体 B、SO2溶于水生成H2SO4 C、用氢氧化钠溶液处理含有SO2的尾气 D、浓H2SO4不稳定,光照易分解6. 下列物质与水反应生成强酸的是( )A、Na2O B、SO3 C、CO2 D、NO7. 下列化合物不能由单质直接化合生成的是( )A、SO3 B、FeS C、Cu2S D、CuCl28.下列元素在一定条件下能实现“单质
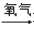 氧化物
氧化物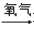 氧化物
氧化物 酸”直接转化的是( )A、硅 B、硫 C、铁 D、铝9. 通过一步反应不能直接完成的是( )
酸”直接转化的是( )A、硅 B、硫 C、铁 D、铝9. 通过一步反应不能直接完成的是( )①N2→NO2②S→SO2 ③NH3→NO④NO→HNO3⑤CuSO4→Cu(NO3)2⑥SiO2→H2SiO3 .
A、①⑥ B、④⑤ C、①④ D、⑤⑥10. 将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( ) A、H2S溶液、稀H2SO4溶液、H2SO3溶液 B、氯水、稀HNO3溶液、NH4Cl溶液 C、H2SO3溶液、稀HCl溶液、氯水 D、H2S溶液、浓盐酸、H2SO3溶液11. 分别将足量下列气体通入稀Na2S溶液中,可以使溶液变浑浊的是( )A、CO B、SO2 C、HCl D、CO212. 某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )
A、H2S溶液、稀H2SO4溶液、H2SO3溶液 B、氯水、稀HNO3溶液、NH4Cl溶液 C、H2SO3溶液、稀HCl溶液、氯水 D、H2S溶液、浓盐酸、H2SO3溶液11. 分别将足量下列气体通入稀Na2S溶液中,可以使溶液变浑浊的是( )A、CO B、SO2 C、HCl D、CO212. 某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( ) A、X可能含有2种盐 B、a是SO3 C、Y可能含有(NH4)2SO4 D、(NH4)2S2O8中S的化合价不可能为+713. 下列说法中正确的是( )A、可用浓硫酸干燥H2、NH3、Cl2等气体 B、向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42﹣ C、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 D、氨水、铵盐受热都易发生化学变化14. 下列说法正确的是( )A、浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铁钝化 B、浓硫酸与蔗糖混合搅拌产生刺激性气味气体,此过程只体现了浓硫酸的脱水性 C、某溶液中加盐酸产生使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32﹣ 或SO32﹣ D、某溶液中滴加BaCl2 . 溶液产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42﹣15. 标准状况下,某同学向100mLH2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示,下列分析中,正确的是( )
A、X可能含有2种盐 B、a是SO3 C、Y可能含有(NH4)2SO4 D、(NH4)2S2O8中S的化合价不可能为+713. 下列说法中正确的是( )A、可用浓硫酸干燥H2、NH3、Cl2等气体 B、向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42﹣ C、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 D、氨水、铵盐受热都易发生化学变化14. 下列说法正确的是( )A、浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铁钝化 B、浓硫酸与蔗糖混合搅拌产生刺激性气味气体,此过程只体现了浓硫酸的脱水性 C、某溶液中加盐酸产生使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32﹣ 或SO32﹣ D、某溶液中滴加BaCl2 . 溶液产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42﹣15. 标准状况下,某同学向100mLH2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示,下列分析中,正确的是( ) A、b 点对应的溶液导电性最强 B、亚硫酸是比氧硫酸更弱的酸 C、原H2S溶液的物质的量浓度为0.05mol•L﹣1 D、ab段反应是:SO2+2H2S═3S↓+2H2O
A、b 点对应的溶液导电性最强 B、亚硫酸是比氧硫酸更弱的酸 C、原H2S溶液的物质的量浓度为0.05mol•L﹣1 D、ab段反应是:SO2+2H2S═3S↓+2H2O二、填空题
-
16. 在①H2S②SO2③CO④Cl2⑤HI⑥CO2六种气体中,符合下列要求的是:(填序号)
(1)属于酸性氧化物的是 ;
(2)能使品红溶液褪色的是 ;
(3)通入石蕊试液先变红后褪色的是 ;
(4)能使湿润淀粉碘化钾试纸变蓝的是 ;
(5)能与Br2水反应的是
17. SO2气体具有气味,(填“易”或“难”)溶于水.将SO2气体通入品红溶液,观察到的现象是 , 说明SO2具有性.18. 有下列几种物质:A.金刚石和石墨 B.C2H6和C5H12 C.C2H4和C2H6 D.CH3CH2CH2CH3和CH3CH(CH3)2 E.35Cl 和37Cl其中属于同分异构体的是(填序号,下同),属于同素异形体的是 , 属于同系物的是 , 属于同位素的是 .
三、综合题
-
19. 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属反应的情况,回答下列问题:(1)、稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为: .(2)、在一定体积的10mol•L﹣1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积(填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 .(3)、欲迅速除去铝壶底部的水垢,又不损坏铝壶,最好的方法是A、浓盐酸 B、稀硝酸 C、冷的浓硝酸 D、冷的浓硫酸.20. 为验证木炭与浓硫酸反应生成的气体中含有CO2和SO2 , 可按如图进行实验.各装置中可供选择的试剂是:①澄清石灰水,②品红溶液,③酸性高锰酸钾溶液.判断各装置所盛试剂后,请回答:
 (1)、写出木炭与浓硫酸反应的化学方程式 .(2)、A中所盛放的试剂是(填写试剂序号,下同).D中所盛试剂应为 .(3)、B装置的作用是 , C装置的作用是 .21.
(1)、写出木炭与浓硫酸反应的化学方程式 .(2)、A中所盛放的试剂是(填写试剂序号,下同).D中所盛试剂应为 .(3)、B装置的作用是 , C装置的作用是 .21.图为浓硫酸与铜片反应的装置.请回答:
 (1)、浓硫酸与铜片反应的化学方程式为(2)、反应一段时间后,试管乙中品红溶液的现象是(3)、下列有关该实验的说法中,不正确的是 .
(1)、浓硫酸与铜片反应的化学方程式为(2)、反应一段时间后,试管乙中品红溶液的现象是(3)、下列有关该实验的说法中,不正确的是 .A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2 , 防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
22. 如图是实验室制取SO2并验证SO2某些性质的装置图.若观察到装置④中有淡黄色沉淀生成,⑤中的溴水褪色(已知因含有Br2而溴水呈红棕色),请回答: (1)、①中发生反应的离子方程式是 .(2)、②中的实验现象是 .(3)、③的实验现象是 , 证明SO2有性.(4)、④中SO2做剂.(5)、⑤中反应生成两种强酸,该反应的离子方程式是 , 当1molSO2参与反应时,转移电子的物质的量是 .(6)、⑥的作用是 .
(1)、①中发生反应的离子方程式是 .(2)、②中的实验现象是 .(3)、③的实验现象是 , 证明SO2有性.(4)、④中SO2做剂.(5)、⑤中反应生成两种强酸,该反应的离子方程式是 , 当1molSO2参与反应时,转移电子的物质的量是 .(6)、⑥的作用是 .