备考2018年高考化学一轮基础复习 专题11 含硅物质与无机非金属材料
试卷更新日期:2017-12-06 类型:一轮复习
一、单选题
-
1. 硅被誉为无机非金属材料的主角,下列物品用到硅单质的是( )A、光电池 B、光导纤维 C、石英钟表 D、陶瓷餐具2. 紫水晶在西方国家代表着“爱的守护石”,其主要成分SiO2属于( )A、碱性氧化物 B、酸性氧化物 C、碱 D、盐3. 下列产品或材料属于复合材料的是( )
①玻璃钢
②采用碳纤维增强复合材料制的钓鱼竿
③航天飞机机身
④航天飞机隔热陶瓷瓦
⑤纳米高分子复合材料.
A、①⑤ B、①②③④⑤ C、②⑤ D、①②③4. 下列说法中,正确的是( )A、酸性氧化物都不与酸溶液反应 B、陶瓷、水泥及所有的玻璃都是硅酸盐产品 C、某些非金属单质既能与酸反应也能与碱反应 D、硅酸盐都是难溶于水的5. 对硅酸盐水泥的叙述不正确的是( )A、是黏土、石灰石、石膏的混合物 B、水泥、沙子和水的混合物成为水泥沙浆 C、水泥、沙子和碎石的混合物称为混凝土 D、水泥和水混合搅拌后很容易凝固变硬具有水硬性6. 下列关于普通玻璃的叙述中,正确的是( )A、玻璃是人类是早使用的硅酸盐材料 B、玻璃在加热熔化时有固定的熔点 C、制普通玻璃的主要原料是纯碱、石灰石、石英 D、普通水泥的成分主要是硅酸钠、硅酸钙和二氧化硅7. O、Si、Al是地壳中含量最多的三种元素,Na、Mg、Cl是海水中的重要元素.下列说法正确的是( )A、普通玻璃、水泥成分中都含有O、Si、Al三种元素 B、从海水中制备Na、Mg、Al三种元素单质的反应都是氧化还原反应 C、电解熔融状态的SiO2、Al2O3可以制得Si、Al,且都有氧气生成 D、加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl28. 根据不同部位工作条件的不同,航天飞机使用了多种防热材料.例如,机身和机翼下表面使用高温陶瓷瓦.下列对新型陶瓷材料的有关叙述中,错误的是( )A、高温结构陶瓷属于新型无机非金属材料,可以作为高级耐火材料 B、氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷 C、氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面 D、新型无机非金属材料克服了传统无机非金属材料的缺点,但是强度比较差9. Na2SiO3的水溶液俗称“水玻璃”,可用于包装材料的胶粘剂.“水玻璃”属于( )A、酸 B、氧化物 C、化合物 D、混合物10. 通过一步反应不能直接完成的是( )①N2→NO2②S→SO2 ③NH3→NO④NO→HNO3⑤CuSO4→Cu(NO3)2⑥SiO2→H2SiO3 .
A、①⑥ B、④⑤ C、①④ D、⑤⑥11. 能证明硅酸的酸性弱于碳酸酸性的实验事实是( )A、CO2溶于水形成碳酸,SiO2难溶于水 B、CO2通入可溶性硅酸盐中析出硅酸沉淀 C、高温下SiO2与碳酸盐反应生成CO2 D、氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀12. 将过量的CO2分别通入:①CaCl2溶液;②Na2SiO3溶液;③Ca(OH)2溶液;④饱和Na2CO3溶液.
最终溶液中有白色沉淀析出的是( )
A、①②③④ B、②④ C、①②③ D、②③13. CaCO3是一种化工原料,可以通过反应生成一系列物质,如图所示.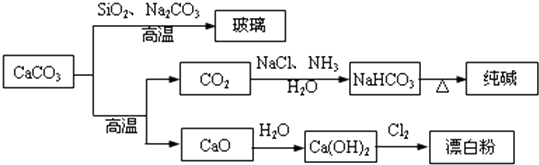
下列说法正确的是( )
A、Cl2和SO2均可以漂白有色物质,且漂白的原理相同 B、由SiO2+Na2CO3 Na2SiO3+CO2↑可知H2CO3的酸性强于H2SiO3 C、工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3 D、制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应二、填空题
-
14. 中国的高铁技术居于国际领先地位.
①高铁座椅内填充有聚氨酯软质泡沫.聚氨酯属于(填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维.光导纤维的主要成分是(填字母).
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥.生产水泥的主要原料为黏土和(填字母).
a.石灰石 b.粗盐 c.纯碱.
15. 化学就在我们身边,它与我们的日常生活、生产密切相关,按要求回答以下问题:(1)中国的瓷器驰名世界,制备陶瓷是以粘土[主要成分Al2Si2O5(OH)x]为原料,经高温烧结而成.式中x= ,若以氧化物形式表示粘土的组成,应写为:
(2)治疗胃酸过多的胃药有效成分主要有氢氧化镁、氢氧化铝、碳酸氢钠等,但如果患有胃溃疡,则不能服用 (填写化学式),以防止胃穿孔.其原因是 (用离子方程式表示)
(3)洁厕灵(强酸性,含盐酸)与84消毒液(碱性,含NaClO)混用可产生一种黄绿色有毒气体,请写出该反应的离子方程式
16.为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
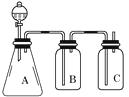
①锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为。
②装置B所盛的试剂是 , 其作用是。
③装置C所盛试剂是 ,
C中反应的离子方程式是。
④由此可得出的结论是:酸性>>。
17. (1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为 .该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是 .(2)除去FeCl2溶液中少量的FeCl3最好加入 物质.
(3)鉴别Na2CO3和NaHCO3溶液可选用 (填序号).
①NaOH ②Ca(OH)2 ③BaCl2 ④K2SO4 ⑤Ca(NO3)2
(4)某溶液中有①SO42﹣②Mg2+③Fe2+④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 .
(5)将盛有18mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是 .
①1.2mL ②2.4mL ③3.6mL ④5.2mL
A.①②B.①③C.②④D.①④
三、综合题
-
18.
(14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
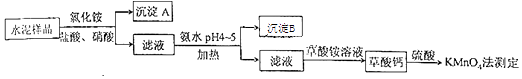
回答下列问题:
(1)、在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸.加入硝酸的目的是 , 还可使用代替硝酸.(2)、沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 .(3)、加氨水过程中加热的目的是 . 沉淀B的主要成分为、(填化学式).(4)、草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4﹣+H++H2C2O4→Mn2++CO2+H2O.实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L﹣1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为 .19. 硅单质及其化合物应用很广。请回答下列问题:(1)、制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、
HCl和另一种物质,写出配平的化学反应方程式;H2
还原SiHCl3过程中若混有O2 , 可能引起的后果是。
(2)、下列有关硅材料的说法正确的是( )。A、单质硅化学性质稳定,但可以被强碱溶液腐蚀 B、盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 C、普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 D、光导纤维的主要成分是SiO2(3)、硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)。
(4)、在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。A、高温结构陶瓷 B、生物陶瓷 C、导电陶瓷