(浙教版)八年级科学上册专项知识点:物质的溶解度
试卷更新日期:2024-09-30 类型:同步测试
一、选择题
-
1. 在配制食盐溶液的过程中,下列操作既能改变食盐的溶解速度又能改变其溶解性的是( )A、搅拌 B、加水 C、加食盐 D、酒精灯加热2. 如图所示,一定温度下,将盛有饱和石灰水的小试管放入盛水的烧杯中,然后向烧杯水中加入某固体物质后,试管中有固体析出,判断加入的某物质可能是( )
 A、硝酸铵固体 B、氢氧化钠固体 C、氯化钠固体 D、蔗糖固体3. 将接近饱和的硝酸钾溶液变成饱和溶液,可采取的方法是( )A、加入硝酸钾 B、升高温度 C、加水 D、加入同温度的硝酸钾饱和溶液4. 如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液的溶质质量分数,下列操作正确的是( )
A、硝酸铵固体 B、氢氧化钠固体 C、氯化钠固体 D、蔗糖固体3. 将接近饱和的硝酸钾溶液变成饱和溶液,可采取的方法是( )A、加入硝酸钾 B、升高温度 C、加水 D、加入同温度的硝酸钾饱和溶液4. 如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液的溶质质量分数,下列操作正确的是( ) A、升温 B、降温 C、加糖 D、搅拌5. 科学的学习要注意对概念的理解,下列有关“一定”的叙述正确的是( )A、均一、稳定的液体一定是溶液 B、有晶体析出的溶液一定是该物质在该温度下的饱和溶液 C、饱和溶液的溶质质量分数一定比不饱和溶液的大 D、不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大6. 如图为配制50g溶质质量分数为10%的食盐溶液的操作过程,下列有关操作与目的分析均正确的是( )
A、升温 B、降温 C、加糖 D、搅拌5. 科学的学习要注意对概念的理解,下列有关“一定”的叙述正确的是( )A、均一、稳定的液体一定是溶液 B、有晶体析出的溶液一定是该物质在该温度下的饱和溶液 C、饱和溶液的溶质质量分数一定比不饱和溶液的大 D、不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大6. 如图为配制50g溶质质量分数为10%的食盐溶液的操作过程,下列有关操作与目的分析均正确的是( )选项
操作
目的
A
用剩的食盐放回原试剂瓶
避免浪费
B
天平调平后在托盘中垫纸
保证称取的食盐质量更准确
C
用50ml量筒替代天平量取所需的水
更加简便
D
溶解时用玻璃棒搅拌
提高食盐的溶解能力
A、A B、B C、C D、D7. 如图,将水分别滴入装有氢氧化钠固体和硝酸铵固体的两支试管中,下列说法错误的是( )。 A、硝酸铵固体溶解时会吸收热量 B、氢氧化钠固体溶解时会放出热量 C、A、B两只烧杯的溶液中都有固体析出 D、A、B两只烧杯中溶液的溶质质量分数都保持不变8. 20℃时,氯化钠的溶解度为36克。则下图中能正确表示该温度下,饱和氯化钠溶液中的溶质和溶剂比例的是( )A、
A、硝酸铵固体溶解时会吸收热量 B、氢氧化钠固体溶解时会放出热量 C、A、B两只烧杯的溶液中都有固体析出 D、A、B两只烧杯中溶液的溶质质量分数都保持不变8. 20℃时,氯化钠的溶解度为36克。则下图中能正确表示该温度下,饱和氯化钠溶液中的溶质和溶剂比例的是( )A、 B、
B、 C、
C、 D、
D、 9. 小金自制了一个“气象瓶”,其密闭玻璃容器内装有硝酸钾和氯化铵及蒸馏水,当外界温度改变,物质溶解度相应变化,会展现出不同形态的结晶。当澄清透明的气象瓶中出现大量晶体时,相关描述正确的是( )
9. 小金自制了一个“气象瓶”,其密闭玻璃容器内装有硝酸钾和氯化铵及蒸馏水,当外界温度改变,物质溶解度相应变化,会展现出不同形态的结晶。当澄清透明的气象瓶中出现大量晶体时,相关描述正确的是( ) A、溶液变为不饱和溶液 B、溶解度不变 C、溶剂质量变小 D、溶质质量变小10. 有100g溶质质量分数为20%的某溶液,要使其溶质质量分数增大一倍,可采用的方法是( )A、蒸发掉50 g水 B、加入100g溶质质量分数为20%的该溶液 C、加入20g溶质 D、燕发掉一半溶剂11. 许多科学概念在逻辑上存在并列、交叉和包含关系,如图所示。下列说法正确的是( )
A、溶液变为不饱和溶液 B、溶解度不变 C、溶剂质量变小 D、溶质质量变小10. 有100g溶质质量分数为20%的某溶液,要使其溶质质量分数增大一倍,可采用的方法是( )A、蒸发掉50 g水 B、加入100g溶质质量分数为20%的该溶液 C、加入20g溶质 D、燕发掉一半溶剂11. 许多科学概念在逻辑上存在并列、交叉和包含关系,如图所示。下列说法正确的是( ) A、纯净物和混合物属于交叉关系 B、混合物和溶液属于包含关系 C、饱和溶液和不饱和溶液属于交叉关系 D、饱和溶液和浓溶液属于并列关系12. 已知20℃时,氯化钠的溶解度为36克。在20℃时小明在甲、乙、丙三个相同的杯子中各注入100克蒸馏水,然后分别加入30克、40克和50克食盐(如图)。充分溶解后这三杯溶液的溶质质量分数大小关系为 ( )
A、纯净物和混合物属于交叉关系 B、混合物和溶液属于包含关系 C、饱和溶液和不饱和溶液属于交叉关系 D、饱和溶液和浓溶液属于并列关系12. 已知20℃时,氯化钠的溶解度为36克。在20℃时小明在甲、乙、丙三个相同的杯子中各注入100克蒸馏水,然后分别加入30克、40克和50克食盐(如图)。充分溶解后这三杯溶液的溶质质量分数大小关系为 ( ) A、甲<乙<丙 B、甲<乙=丙 C、丙<乙<甲 D、甲=乙<丙13. 甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )
A、甲<乙<丙 B、甲<乙=丙 C、丙<乙<甲 D、甲=乙<丙13. 甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( ) A、甲一定是不饱和溶液 B、丙和丁一定是饱和溶液 C、乙的溶质质量分数一定比甲大 D、甲和丙的溶质质量分数一定不相等14. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,下列溶液质量分数与蒸发过程描述正确的是( )
A、甲一定是不饱和溶液 B、丙和丁一定是饱和溶液 C、乙的溶质质量分数一定比甲大 D、甲和丙的溶质质量分数一定不相等14. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,下列溶液质量分数与蒸发过程描述正确的是( ) A、
A、 B、
B、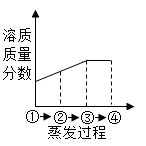 C、
C、 D、
D、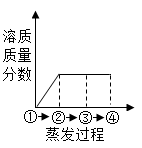 15. 固体甲、乙、丙在不同温度下的溶解度如表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )
15. 固体甲、乙、丙在不同温度下的溶解度如表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )温度/℃ 0 20 40 60 80 溶解度/g 甲 0.18 0.16 0.14 0.12 0.09 乙 35.7 36.0 36.6 37.3 38.4 丙 13.3 31.6 63.9 110 169 A、固体甲的溶解度随温度的升高而增大 B、20℃时,丙溶液中溶质和溶剂质量比为31.6:100 C、分别将等质量的乙、丙饱和溶液由60℃降温到20℃,溶液中溶质质量大小:丙>乙 D、分别将等质量的甲、丙饱和溶液由60℃降温到20℃,溶液中溶剂质量大小:甲>丙16. 下表是氯化钾(KCl)和硝酸钾(KNO3)在不同温度时的溶解度。下列说法不正确的是( )温度/℃
20
30
40
50
溶解度/(g/100g水)
KCl
34.0
37.0
40.0
42.6
KNO3
31.6
45.8
63.9
85.5
A、20℃时,氧化钾的溶解度大于硝酸钾的溶解度 B、两种物质溶解度相等的温度在20~30℃之间 C、40℃时,5g氯化钾中加10 g水可得质量分数为33.3%的溶液 D、50℃时,10g硝酸钾中加20g水,充分溶解后再降温到30℃,有硝酸钾固体析出17. 已知氯化钠的溶解度随温度的升高而稍有增大。如图所示为蒸发氯化钠溶液的实验过程,其中a、b为恒温蒸发过程,c为升温蒸发过程,②中溶液恰好为饱和状态。分析实验过程,作出的判断不正确的是( )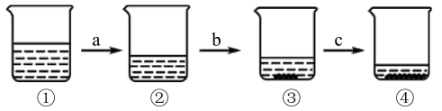 A、经历a过程后,②中氯化钠的质量分数大于① B、经历a过程后,②中氯化钠的溶解度仍等于① C、经历b过程后,③中氯化钠的质量分数大于② D、经历c过程后,④中氯化钠的质量分数大于③18. 有一固体物质(不含结晶水)的溶液甲,在一定温度下经历如下变化,下列说法正确的是( )
A、经历a过程后,②中氯化钠的质量分数大于① B、经历a过程后,②中氯化钠的溶解度仍等于① C、经历b过程后,③中氯化钠的质量分数大于② D、经历c过程后,④中氯化钠的质量分数大于③18. 有一固体物质(不含结晶水)的溶液甲,在一定温度下经历如下变化,下列说法正确的是( ) A、该温度下,固体物质的溶解度是30g B、溶液乙和溶液丙中的溶质质量分数可能相等 C、溶液乙一定是不饱和溶液 D、溶液丙再蒸发10g水,析出晶体质量一定大于3g19. 如图是硝酸钾的溶解度曲线,某同学在20℃时进行了如图实验,得到相应的溶液①~④。下列说法正确的是( )
A、该温度下,固体物质的溶解度是30g B、溶液乙和溶液丙中的溶质质量分数可能相等 C、溶液乙一定是不饱和溶液 D、溶液丙再蒸发10g水,析出晶体质量一定大于3g19. 如图是硝酸钾的溶解度曲线,某同学在20℃时进行了如图实验,得到相应的溶液①~④。下列说法正确的是( )
 A、①→②的过程中溶解度增大 B、②→③的过程中溶质质量分数不变 C、④所得的溶液中溶质质量分数约为24% D、20℃时,100克硝酸钾饱和溶液中含有硝酸钾31.6克20. 已知30℃时,氯化铵的溶解度为41.4g,硝酸钾的溶解度为45.8g。若取这两种盐各22g,按图示进行实验。下列说法不正确的是( )
A、①→②的过程中溶解度增大 B、②→③的过程中溶质质量分数不变 C、④所得的溶液中溶质质量分数约为24% D、20℃时,100克硝酸钾饱和溶液中含有硝酸钾31.6克20. 已知30℃时,氯化铵的溶解度为41.4g,硝酸钾的溶解度为45.8g。若取这两种盐各22g,按图示进行实验。下列说法不正确的是( )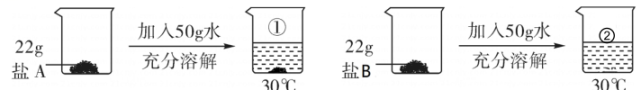 A、盐A是氯化铵 B、充分搅拌能使①中盐A继续溶解 C、②中溶液为不饱和溶液 D、②中溶液的溶质质量分数小于44%
A、盐A是氯化铵 B、充分搅拌能使①中盐A继续溶解 C、②中溶液为不饱和溶液 D、②中溶液的溶质质量分数小于44%二、填空题
-
21. 溶液在日常生活和工农业生产中具有广泛用途。则回答下列问题:(1)、碘酒是医院常用的消毒药品,碘酒中的溶剂是。(2)、喝了汽水会打嗝,说明气体的溶解度与有关。22. 向图甲装有水的小试管中加入一定量的氢氧化钠固体,出现如图乙现象,则此时瓶内气压(选填“大于”、“等于”或“小于”)外界大气压,说明氢氧化钠溶于水(选填“吸热”或“放热”)。
 23. 图中的四个圆分别表示浓溶液、稀溶液、饱和溶液和不饱和溶液。
23. 图中的四个圆分别表示浓溶液、稀溶液、饱和溶液和不饱和溶液。 (1)、通过对阴影B的分析,可得出结论。(2)、医生建议夏季出汗过多的时候喝些”淡盐水”,“淡盐水”可归于图中(填“A”、”B”、“C”或”D”)。24. t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。
(1)、通过对阴影B的分析,可得出结论。(2)、医生建议夏季出汗过多的时候喝些”淡盐水”,“淡盐水”可归于图中(填“A”、”B”、“C”或”D”)。24. t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。 (1)、甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。(2)、甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。(3)、t℃时该物质的溶解度为 g。25. 硝酸钾的溶解度随温度升高而增大。如图所示是对硝酸钾溶液的实验操作及变化情况,以及同一小球在三种溶液中的浮沉情况。请回答下列问题:
(1)、甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。(2)、甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。(3)、t℃时该物质的溶解度为 g。25. 硝酸钾的溶解度随温度升高而增大。如图所示是对硝酸钾溶液的实验操作及变化情况,以及同一小球在三种溶液中的浮沉情况。请回答下列问题: (1)、操作I可能是 (选填字母)。A、降低温度 B、加入硝酸钾 C、蒸发水分(2)、小球所受的浮力F①、F②、F③的大小关系正确的是 。A、F①<F②=F③ B、F①<F②<F③ C、F①>F②=F③ D、F①=F②=F③(3)、从②到③,烧杯底析出硝酸钾晶体5克,整个装置总质量减少了20克,可知②中的溶质质量分数是。26. 20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度如图3。
(1)、操作I可能是 (选填字母)。A、降低温度 B、加入硝酸钾 C、蒸发水分(2)、小球所受的浮力F①、F②、F③的大小关系正确的是 。A、F①<F②=F③ B、F①<F②<F③ C、F①>F②=F③ D、F①=F②=F③(3)、从②到③,烧杯底析出硝酸钾晶体5克,整个装置总质量减少了20克,可知②中的溶质质量分数是。26. 20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度如图3。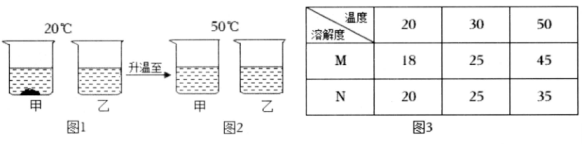 (1)、图1中甲是溶液(选填“饱和”或“不饱和”)。(2)、图2中两溶液溶质质量分数一定 (选填 “相等”或“不相等”);(3)、图3中M表示的是物质(选填“甲”或“乙”)27. 下表是氯化铵与硝酸钾在不同温度时的溶解度,请回答:
(1)、图1中甲是溶液(选填“饱和”或“不饱和”)。(2)、图2中两溶液溶质质量分数一定 (选填 “相等”或“不相等”);(3)、图3中M表示的是物质(选填“甲”或“乙”)27. 下表是氯化铵与硝酸钾在不同温度时的溶解度,请回答:温度/℃
10
20
30
40
50
60
溶解度/g
氯化铵
33.3
37.2
41.4
45.8
50.4
55.2
硝酸钾
20.9
31.6
45.8
63.9
85.5
110
 (1)、将100克60℃时的氯化铵和硝酸钾的饱和溶液同时降温到10℃,两者析出晶体(填“氯化铵较多”、“硝酸钾较多”或“无法确定”)。(2)、下图中M是氯化铵,按图进行相关操作,其中A、B、C、D四个烧杯中溶质质量分数的大小关系是。28. 20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。
(1)、将100克60℃时的氯化铵和硝酸钾的饱和溶液同时降温到10℃,两者析出晶体(填“氯化铵较多”、“硝酸钾较多”或“无法确定”)。(2)、下图中M是氯化铵,按图进行相关操作,其中A、B、C、D四个烧杯中溶质质量分数的大小关系是。28. 20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。 (1)、图1中一定是饱和溶液的是溶液(填“甲”或“乙”);图2中乙溶液一定是溶液(填“饱和”或“不饱和”)。(2)、图3中表示乙的溶解度曲线的是(填“M”或“N”);图2中乙溶液降温至30℃析出晶体(填“会”或“不会”)。29. 为了探究溶质质量分数与加入水的质量的关系,小明在配制20℃时硝酸钾溶液过程中,他向硝酸钾中分批加水,充分搅拌,流程如下图:
(1)、图1中一定是饱和溶液的是溶液(填“甲”或“乙”);图2中乙溶液一定是溶液(填“饱和”或“不饱和”)。(2)、图3中表示乙的溶解度曲线的是(填“M”或“N”);图2中乙溶液降温至30℃析出晶体(填“会”或“不会”)。29. 为了探究溶质质量分数与加入水的质量的关系,小明在配制20℃时硝酸钾溶液过程中,他向硝酸钾中分批加水,充分搅拌,流程如下图: (1)、小明认为,甲烧杯中的溶液一定是饱和溶液。他的判断依据是。(2)、丙烧杯中的溶液静置一段时间后不分层,这说明溶液具有的特点。(3)、下图中可能符合上述实验结果的描点有____(填字母)。A、
(1)、小明认为,甲烧杯中的溶液一定是饱和溶液。他的判断依据是。(2)、丙烧杯中的溶液静置一段时间后不分层,这说明溶液具有的特点。(3)、下图中可能符合上述实验结果的描点有____(填字母)。A、 B、
B、 C、
C、 D、
D、
三、实验探究题
-
30. 某小组同学计划用如图所示的实验研究影响冰糖溶解快慢的因素,请回答下列问题。
 (1)、根据图示的信息,你认为该组同学假设影响冰糖溶解快慢的因素有、等。(2)、若研究搅拌对冰糖溶解快慢的影响,应选择(填烧杯编号)与A进行对照。(3)、选择 A 和C同时进行实验时,小科发现 A 中冰糖溶解得快,他由此得出结论:块状冰糖比粉末状冰糖溶解得快。你认为他的结论对吗? (填“对”或“错”)。你的理由是31. 某化学兴趣小组探究氯化铵、氯化钙、氯化钠三种物质溶于水过程中的热量变化。
(1)、根据图示的信息,你认为该组同学假设影响冰糖溶解快慢的因素有、等。(2)、若研究搅拌对冰糖溶解快慢的影响,应选择(填烧杯编号)与A进行对照。(3)、选择 A 和C同时进行实验时,小科发现 A 中冰糖溶解得快,他由此得出结论:块状冰糖比粉末状冰糖溶解得快。你认为他的结论对吗? (填“对”或“错”)。你的理由是31. 某化学兴趣小组探究氯化铵、氯化钙、氯化钠三种物质溶于水过程中的热量变化。【药品器材】水、氯化铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等。
【实验探究】三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
实验
水的体积
所加物质
测量液体温度(℃)
实验1
50mL
氯化铵
15
实验2
50mL
氯化钙
28
实验3
X
氯化钠
21
实验4
50mL
无
22
(1)、表中X为mL。(2)、比较实验2与实验4,可获得的结论是。(3)、如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是。(4)、经讨论认为本实验操作中存在缺陷,它是 (填选项,可多选)。A、实验操作过程没有采取较为严格的保温措施 B、加入物质的质量可能不相等 C、加入物质的种类不一样。32. 小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。 (1)、需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。(2)、量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。(3)、丙中玻璃棒的作用是 。(4)、下列操作会导致配制的氯化钠溶液质量分数偏小的有 ____。A、砝码磨损 B、氯化钠固体不纯 C、按照图乙的方法读数 D、将量筒中的水倒入烧杯时,有水洒出33. 配制一定质量分数的溶液的实验是中考考查的实验之一,下图是小明配制100g溶质质量分数为12%的氯化钠溶液的实验操作示意图:
(1)、需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。(2)、量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。(3)、丙中玻璃棒的作用是 。(4)、下列操作会导致配制的氯化钠溶液质量分数偏小的有 ____。A、砝码磨损 B、氯化钠固体不纯 C、按照图乙的方法读数 D、将量筒中的水倒入烧杯时,有水洒出33. 配制一定质量分数的溶液的实验是中考考查的实验之一,下图是小明配制100g溶质质量分数为12%的氯化钠溶液的实验操作示意图: (1)、指出图中的一处错误操作。(2)、用上述图示的序号表示配制溶液的操作顺序。(3)、上述实验操作中,②中的玻璃棒的作用是。(4)、若在称量氯化钠的质量时,放好砝码和调好游码后,向左盘上加氯化钠时,发现指针偏向分度盘的左边,接下来应进行的操作。(5)、下列实验操作中会导致氯化钠溶液溶质质量分数偏低的是。
(1)、指出图中的一处错误操作。(2)、用上述图示的序号表示配制溶液的操作顺序。(3)、上述实验操作中,②中的玻璃棒的作用是。(4)、若在称量氯化钠的质量时,放好砝码和调好游码后,向左盘上加氯化钠时,发现指针偏向分度盘的左边,接下来应进行的操作。(5)、下列实验操作中会导致氯化钠溶液溶质质量分数偏低的是。A.溶解食盐的烧杯用水洗涤后未干燥就使用
B.加水溶解过程中有少量水溅出
C.量取水的操作中仰视量筒凹液面最低处读数D.食盐中含有少量泥沙
34. 某科学小组用氯化钠固体配制50g质量分数为6%的氯化钠溶液,操作过程如图: (1)、该实验的正确操作顺序为(填字母序号)。(2)、请指出实验中一处明显的错误操作。(3)、①需要氯化钠的质量为g。
(1)、该实验的正确操作顺序为(填字母序号)。(2)、请指出实验中一处明显的错误操作。(3)、①需要氯化钠的质量为g。②纠正错误后,正确称量氯化钠时,若发现天平指针向左偏,接下去的操作是。
(4)、经检测,所配制溶液的溶质质量分数偏小,其原因不可能是。A.氯化钠固体不纯 B.称量时,砝码端忘垫质量相同的纸片 C.量取水时,仰视读数 D.装瓶时,有少量溶液洒出四、解答题
-
35. 现有8%的氯化钠溶液50g,若使其溶质的质量分数增大到20%,可采用的方法:(1)、需要蒸发多少克水?(2)、需要加入多少克氯化钠?(3)、需要加入多少克40%的氯化钠溶液?36. 氢氧化钠常温下是一种白色晶体,具有强腐蚀性。易溶于水,在生产染料、塑料、药剂等方面也要使用大量的氢氧化钠。现用质量分数为16%的氢氧化钠溶液(密度为1.2g/cm3)去配制60g质量分数为8%的氢氧化钠溶液。(1)、60g质量分数为8%的氢氧化钠溶液中,溶质的质量为克。(2)、需要质量分数为16%的氢氧化钠溶液多少毫升?需要水多少毫升?37. “过氧乙酸”消毒液广泛用于教室、食堂、寝室等场所的卫生消毒。某品牌“过氧乙酸”消毒液标签如下表所示。
过氧乙酸(1L)
溶质质量分数
20%
密度
1.2 g/cm3
强腐蚀性、阴冷处存放
(1)、取该消毒液1L,其中含过氧乙酸克。(2)、取12g该溶液配制成溶质质量分数为0.5%的过氧乙酸溶液用来消毒,请计算需要加入水的质量?38. 咸鸭蛋是中国特色食品,风味独特、营养丰富深受人们喜爱。其腌制过程如下:(1)、第一步:挑选鸭蛋。将鸭蛋放入一定溶质质量分数的食盐溶液,通过观察鸭蛋的浮沉情况进行挑选。现有四种食盐溶液供选择,其溶质质量分数与密度关系如表一。鸭蛋的新鲜情况与其密度变化如图一。分析图一和表一信息,应选用表一中溶质质量分数为的食盐溶液才能挑选出新鲜鸭蛋。 (2)、第二步:配制溶液。使用溶质质量分数过大的食盐溶液,鸭蛋的水分流失快、味咸且口感不鲜;使用溶质质量分数过小的食盐溶液,防腐能力较差、营养价值会降低。人们常选用质量分数为10%~20%的食盐溶液。现配制2000毫升质量分数为15%食盐溶液,需要食盐多少克。(3)、第三步:浸泡腌制。将鸭蛋放入容器再倒入15%食盐溶液将其浸没,加盖保存,如图二所示。图二中鸭蛋A的体积为70厘米3 , 计算鸭蛋A所受的浮力大小。
(2)、第二步:配制溶液。使用溶质质量分数过大的食盐溶液,鸭蛋的水分流失快、味咸且口感不鲜;使用溶质质量分数过小的食盐溶液,防腐能力较差、营养价值会降低。人们常选用质量分数为10%~20%的食盐溶液。现配制2000毫升质量分数为15%食盐溶液,需要食盐多少克。(3)、第三步:浸泡腌制。将鸭蛋放入容器再倒入15%食盐溶液将其浸没,加盖保存,如图二所示。图二中鸭蛋A的体积为70厘米3 , 计算鸭蛋A所受的浮力大小。