浙江省台州市2017-2018学年九年级上学期科学期中考试试卷
试卷更新日期:2017-12-06 类型:期中考试
一、选择题
-
1. 纳米(nm)是一种长度单位,1nm=10-9m,纳米科技开辟了人类认识世界的新层面。纳米材料科技是纳米科技最基本的组成部分,把固体物质加工到纳米级(1nm~100nm)的超细粉末,即可得到纳米材料。这种加工过程属于( )A、化学变化 B、物理变化 C、既有物理变化又有化学变化 D、既不是物理变化又不是化学变化2. 下列实验操作正确的是( )A、CO2验满
 B、倾倒试剂
B、倾倒试剂  C、滴加液体
C、滴加液体  D、稀释浓硫酸
D、稀释浓硫酸 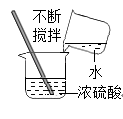 3. 学习化学可以帮助你变得聪明,防止走入生活和学习的某些误区.你认为下列说法不正确的是( )A、水银不是银而是金属汞,常温常压下呈液态,有毒 B、干冰不是冰,而是固体二氧化碳 C、铅笔芯中不含铅,主要是石墨和粘土 D、苛性钠不是钠,而是一种常见的盐4. 黄金是Au对应的单质,化学性质很稳定。而假黄金是铜锌合金,颜色和外形似黄金。下列不能区分黄金和假黄金的方案是( )A、在空气中灼烧 B、放在盐酸中 C、放在NaOH 溶液中 D、放在AgNO3溶液中5. 酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以解离出来H+ , 从而呈现酸性,主要用于饮料添加剂或药物工业原料,下列物质不能与酒石酸反应的是( )
3. 学习化学可以帮助你变得聪明,防止走入生活和学习的某些误区.你认为下列说法不正确的是( )A、水银不是银而是金属汞,常温常压下呈液态,有毒 B、干冰不是冰,而是固体二氧化碳 C、铅笔芯中不含铅,主要是石墨和粘土 D、苛性钠不是钠,而是一种常见的盐4. 黄金是Au对应的单质,化学性质很稳定。而假黄金是铜锌合金,颜色和外形似黄金。下列不能区分黄金和假黄金的方案是( )A、在空气中灼烧 B、放在盐酸中 C、放在NaOH 溶液中 D、放在AgNO3溶液中5. 酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以解离出来H+ , 从而呈现酸性,主要用于饮料添加剂或药物工业原料,下列物质不能与酒石酸反应的是( )
A、Mg B、Fe2O3 C、NaOH D、CO26. 实验室许多药品需要密封保存,下列关于密封保存的原因,解释正确的是( )A、浓盐酸——防止HCl气体挥发 B、生石灰──防止氧化 C、浓硫酸——防止与空气中CO2反应 D、Na2CO3·10H2O固体——防止吸水潮解7. 吴子熊玻璃艺术馆位于浙江台州,是我国第一家玻璃雕刻艺术馆,其玻璃(主要成分是SiO2)工艺品栩栩如生,如图是一块雕刻了精美图案的玻璃,小铭对它的制作过程产生了浓厚兴趣,通过查阅资料了解到玻璃雕刻过程中用到的是氢氟酸,发生的反应为4HF+SiO2=SiF4↑+2H2O,该反应的类型是( ) A、置换反应 B、分解反应 C、化合反应 D、复分解反应8. 电镀厂排放的废水中含有较多量的CuCl2 , 其中的Cu2+会危害人的身体健康,为了降低污染,同时又能回收金属铜,可往废水中投入( )A、活性炭 B、铜板 C、铁丝网 D、白银9. 下列实验方法不能达到目的的是( )
A、置换反应 B、分解反应 C、化合反应 D、复分解反应8. 电镀厂排放的废水中含有较多量的CuCl2 , 其中的Cu2+会危害人的身体健康,为了降低污染,同时又能回收金属铜,可往废水中投入( )A、活性炭 B、铜板 C、铁丝网 D、白银9. 下列实验方法不能达到目的的是( )
A、用燃烧的方法区分棉花和羊毛 B、用带火星的木条鉴别氧气和氮气 C、用氢氧化钙检验铵态氮肥 D、用稀盐酸除去铁粉中混有的少量铜粉10. 科学知识与生产生活联系紧密.下列物质用途错误的是( )选项
A
B
C
D
物质
氯化钠
二氧化碳
浓硫酸
氢气
用途
除铁锈
作气体肥料
作干燥剂
作燃料
A、A B、B C、C D、D11. 如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论错误的是( )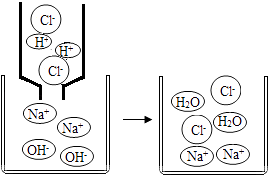 A、向反应结束时的溶液中滴入酚酞溶液,溶液不变色 B、反应前后元素的种类没有变化 C、反应后溶液中存在的粒子只有Na+和Cl﹣ D、该反应的实质是H+和OH﹣ 结合生成水12. 某种消化药片的有效成分是氢氧化镁,能减缓因胃酸过多引起的胃痛.在氢氧化镁与胃酸作用的过程中,胃液的pH变化的情况符合如图中的( )A、
A、向反应结束时的溶液中滴入酚酞溶液,溶液不变色 B、反应前后元素的种类没有变化 C、反应后溶液中存在的粒子只有Na+和Cl﹣ D、该反应的实质是H+和OH﹣ 结合生成水12. 某种消化药片的有效成分是氢氧化镁,能减缓因胃酸过多引起的胃痛.在氢氧化镁与胃酸作用的过程中,胃液的pH变化的情况符合如图中的( )A、 B、
B、 C、
C、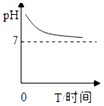 D、
D、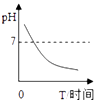 13. 下列推理正确的是( )A、酸雨呈酸性,呈酸性的雨水一定是酸雨 B、酸碱反应生成盐和水,生成盐和水的反应一定是酸碱反应 C、碱性溶液能使酚酞溶液变红,能使酚酞溶液变红的溶液一定呈碱性 D、盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐14. 在体育考试中,小明投出的实心球在空中的运动轨迹如图所示.若实心球重20N,从最高点到落地点的过程中,球下降的高度为2.7m,则( )
13. 下列推理正确的是( )A、酸雨呈酸性,呈酸性的雨水一定是酸雨 B、酸碱反应生成盐和水,生成盐和水的反应一定是酸碱反应 C、碱性溶液能使酚酞溶液变红,能使酚酞溶液变红的溶液一定呈碱性 D、盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐14. 在体育考试中,小明投出的实心球在空中的运动轨迹如图所示.若实心球重20N,从最高点到落地点的过程中,球下降的高度为2.7m,则( )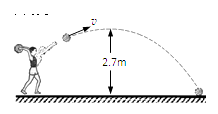 A、实心球到达最高点时机械能为零 B、实心球从最高点到落地点的过程中将重力势能转化为动能 C、从最高点到落地点重力做功为零 D、实心球在空中飞行时小明一直对球做功15. 如图所示,用F =20N的水平推力推着重为40 N的物体沿水平方向做直线运动,若推力F对物体做了 40 J的功,则在这一过程中( )
A、实心球到达最高点时机械能为零 B、实心球从最高点到落地点的过程中将重力势能转化为动能 C、从最高点到落地点重力做功为零 D、实心球在空中飞行时小明一直对球做功15. 如图所示,用F =20N的水平推力推着重为40 N的物体沿水平方向做直线运动,若推力F对物体做了 40 J的功,则在这一过程中( )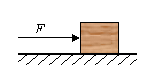 A、重力做的功一定为40J B、物体一定受到20 N的摩擦力 C、物体一定运动了2 m D、物体一定运动了4m
A、重力做的功一定为40J B、物体一定受到20 N的摩擦力 C、物体一定运动了2 m D、物体一定运动了4m二、填空题
-
16. 2009年诺贝尔物理学奖授予英国华裔科学家高锟以及两位美国科学家.高锟获奖,是因为他在“有关光在纤维中的传输以用于光学通信方面”做出了突破性成就:提出用玻璃制造比头发丝更细的光纤,取代铜导线作为长距离通讯线路.这个理论引起了世界通信技术的一次革命.(1)、光纤这种材料属于 . (填写编号)A、金属材料 B、无机非金属材料 C、有机合成材料 D、纳米材料(2)、光纤的质量要求极严.目前使用的光纤是纯度极高的超纯SiO2 , 其制造时的反应原理是:SiCl4(气)+O2(气) SiO2(固)+2Cl2(气)该反应属于(填基本化学反应类型).17. 生活中的铁制品生锈的常用措施有(写一点即可),也可在铁片表面镀上一层锌,表面会形成一层保护薄膜,其中含有Zn2(OH)2CO3 . 若该物质通过化合反应生成,试推断,反应物除了Zn、水和氧气外,还应有(填一种常见物质).18. 下列分别盛有不同物质的容器中,所盛物质属于纯净物的是单质的是 ,化合物的是。(均填容器代号)
 19. 化学小组探究镁、铁、铜三种金属的活动性顺序,设计了下图所示实验方案.
19. 化学小组探究镁、铁、铜三种金属的活动性顺序,设计了下图所示实验方案. (1)、试管乙中观察到的现象是 , (写一点即可)反应的化学方程式为 .(2)、同学们经讨论后认为该方案可以优化,试管的实验是多余的.20. 某河道两旁有甲、乙两工厂,它们排放的工业废水中,含有硫酸铜、氢氧化钾、硝酸钡、硫酸钾、硝酸镁五种物质,且甲、乙两厂排放的废水中所含物质各不相同.已知甲厂的废水中含三种物质,则乙厂的废水中所含物质应该是和 . 将甲厂和乙厂的废水按适当的比例混合,可以使废水中的含有能做复合肥的物质是 , 可用来浇灌农田21. “碳捕捉技术”是通过一定的方法,将工业生产中产生的二氧化碳分离出来并加以利用.某校科研小组的同学设计用NaOH溶液来“捕捉”二氧化碳,其基本过程如下(部分条件及物质未标出).
(1)、试管乙中观察到的现象是 , (写一点即可)反应的化学方程式为 .(2)、同学们经讨论后认为该方案可以优化,试管的实验是多余的.20. 某河道两旁有甲、乙两工厂,它们排放的工业废水中,含有硫酸铜、氢氧化钾、硝酸钡、硫酸钾、硝酸镁五种物质,且甲、乙两厂排放的废水中所含物质各不相同.已知甲厂的废水中含三种物质,则乙厂的废水中所含物质应该是和 . 将甲厂和乙厂的废水按适当的比例混合,可以使废水中的含有能做复合肥的物质是 , 可用来浇灌农田21. “碳捕捉技术”是通过一定的方法,将工业生产中产生的二氧化碳分离出来并加以利用.某校科研小组的同学设计用NaOH溶液来“捕捉”二氧化碳,其基本过程如下(部分条件及物质未标出).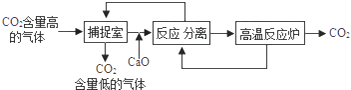
请回答下列有关问题:
(1)、“捕捉室”中发生反应的化学方程式为: .(2)、在整个“捕捉”过程中,可以循环利用的物质是 .22. 如图为四旋翼无人机,下方悬挂着一个质量为0.1千克的摄像机。在10秒内无人机从地面竖直上升了20米,然后边摄像边斜向上飞行了30秒,仪表盘上显示离地高度为36米。无人机前10秒对摄像机做功焦,整个过程中,无人机对摄像机做功的功率为瓦。 23. 如下左图,摆球从A点向下摆动,在由A到B的过程中,摆球在点的动能最大,如果没有摩擦,则摆球的机械能将会(选填“增大”、“减小”、“不变”).将摆球换成盛沙的漏斗下边放一木板,让漏斗摆动起来,同时其中细沙匀速流出且不计阻力,如下右图所示经历一段时间后,观察木板上沙子的堆积情况,则沙堆的剖面应是下图中的 .
23. 如下左图,摆球从A点向下摆动,在由A到B的过程中,摆球在点的动能最大,如果没有摩擦,则摆球的机械能将会(选填“增大”、“减小”、“不变”).将摆球换成盛沙的漏斗下边放一木板,让漏斗摆动起来,同时其中细沙匀速流出且不计阻力,如下右图所示经历一段时间后,观察木板上沙子的堆积情况,则沙堆的剖面应是下图中的 .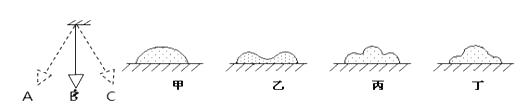
三、探究题
-
24. “寓学于乐”是一种有效的学习方式,如图是“盖房子”的游戏示意图,其规则是根据“上下相邻两层的物质之间均可发生化学反应”来堆砌楼层。图中已放置好四种物质,还有二氧化碳、碳酸钠溶液、硫酸铜溶液三种物质待放置。请回答:
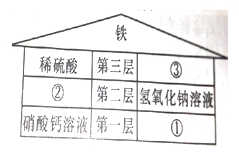 (1)、、二氧化碳应放在处(填序号);(2)、、将氢氧化钠溶液滴到③中,产生的实验现象是;(3)、、第二层内的两物质间能相互转化,请写其中的一个化学方程式25. 探究影响物体弹性势能大小的因素,选择弹簧进行研究。将光滑水平面与光滑斜面连接,如图:
(1)、、二氧化碳应放在处(填序号);(2)、、将氢氧化钠溶液滴到③中,产生的实验现象是;(3)、、第二层内的两物质间能相互转化,请写其中的一个化学方程式25. 探究影响物体弹性势能大小的因素,选择弹簧进行研究。将光滑水平面与光滑斜面连接,如图:
①将甲弹簧放置在水平面上,用小球压缩弹簧2厘米,释放后,小球滚上A斜面,记录小球在斜面最高点时高度,重复三次,取平均值记录在下表中。更换B斜面,重复实验。
②压缩甲弹簧3厘米,重复实验①步骤。③换用不同弹簧,重复实验①步骤。
实验
序号
弹
簧
弹簧长
度/厘米
弹簧
材料
压缩量
/厘米
小球在斜面A上高度/米
小球在斜面B上高度/米
1
甲
20
合金1
2
0.18
0.18
2
甲
20
合金1
3
0.40
0.40
3
乙
20
合金2
2
0.22
0.22
4
丙
30
合金1
2
0.12
0.12
5
丁
30
合金2
2
0.15
0.15
(1)、实验中,通过观察判断弹簧弹性势能的大小。(2)、比较(选填实验序号),说明弹簧的弹性势能大小与弹簧的形变大小有关。(3)、由实验结果可知,弹簧的弹性势能大小还与弹簧的有关。26. 某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红.碱溶液可以使酚酞溶液变红是因为碱在水溶液中解离出OH- , 那么Na2CO3溶液中究竟是哪种粒子可以使酚酞溶液变红呢?他们设计了如图所示Ⅰ、Ⅱ、Ⅲ,3个实验,请你和他们一起探究.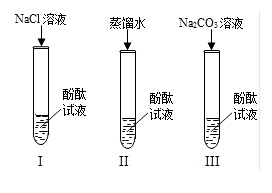 (1)、小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是 .(2)、实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时实验还观察到了现象.由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞溶液变红.(3)、小组同学在与老师交流上述结论时,老师说:“Na2CO3中CO32-在溶液中能发生水解生成OH-,水解方程式为CO32-+H2O=HCO3-+OH-”你认为能使酚酞溶液变红也是由于溶液中存在27. 据报道,我国已在南海某海域试采可燃冰获得成功。可燃冰分布于深海沉积物或陆域的永久冻土中,主要是由甲烷(CH4)与水在高压低温条件下形成的类冰状结晶物质,可燃烧,所以被称为“可燃冰”。
(1)、小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是 .(2)、实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时实验还观察到了现象.由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞溶液变红.(3)、小组同学在与老师交流上述结论时,老师说:“Na2CO3中CO32-在溶液中能发生水解生成OH-,水解方程式为CO32-+H2O=HCO3-+OH-”你认为能使酚酞溶液变红也是由于溶液中存在27. 据报道,我国已在南海某海域试采可燃冰获得成功。可燃冰分布于深海沉积物或陆域的永久冻土中,主要是由甲烷(CH4)与水在高压低温条件下形成的类冰状结晶物质,可燃烧,所以被称为“可燃冰”。
(1)、已知家用液化气的主要成分是丁烷(C4H10),天然气的主要成分甲烷(CH4)在相同条件下,1米3 C4H10和1米3 CH4所含的分子数目相同。C4H10、CH4燃烧的化学方程式分别为2C4H10+13O2 8CO2+10H2O,CH4+2O2 CO2+2H2O。据此分析,在相同条件下,分别燃烧1米3的C4H10与CH4 , 消耗氧气较多的是。
(2)、燃气灶由灶体、进燃气管、进空气管、电子开关等部件组成.目前的管道煤气用户由丁烷(C4H10)改用天然气,必须对燃气灶加以改造.如果进燃气管的直径不变,改造后的燃气灶与原来的相比,进空气管的直径应(填“增大”或“减小”)
28. 小苏打(NaHCO3)和食盐(NaCl)是厨房中常用物质。现有一包白色固体,可能由NaHCO3和NaCl中的一种或两种组成。某科学小组同学展开了系列拓展性研究。(1)、定性分析【实验目的】确定白色固体的组成
【实验方案】
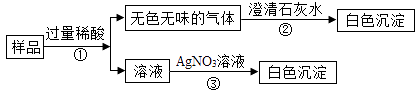
【实验结论】该白色固体由NaHCO3和NaCl两种物质组成,
则步骤②中发生的化学方程式是。
(2)、定量分析【实验目的】测定该白色固体中NaHCO3的质量分数
为了测定该样品中NaHCO3的质量分数,小吕、小周分别取a克该样品,设计了如下方案:
小吕方案Ⅰ:利用NaHCO3与稀硫酸反应产生CO2 , 通过测定生成CO2的质量,计算样品中NaHCO3的质量分数。
小吕用下列装置完成本实验,装置的连接顺序是 (填装置的字母编号,装置不重复使用);(C中碱石灰的作用:吸收空气中倒吸入的的水和二氧化碳)
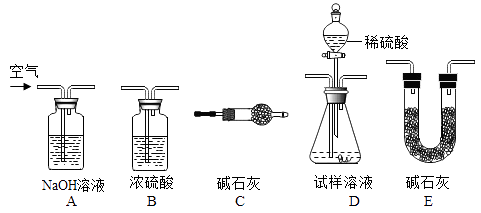
D装置中的反应完全后,需再次通入空气,其目的是__。
小周方案Ⅱ:小周用沉淀法测定样品中NaHCO3的质量分数。操作流程如下:
(已知:NaHCO3+NaOH=Na2CO3+H2O)

为使定量分析更准确,在操作Ⅰ之前,需判断所加BaCl2溶液是否过量,请你设计一个合理方案:。
四、分析计算题
-
29. 据报道,最近科学家发现,鱼腥草等中草药含有对人体有害的成分马兜铃酸(C17H11NO7)(相对分子质量341),可能具备肾毒性,会引起肾脏纤维化,导置尿路上皮癌,造成可积累且不可逆的肾损伤,而且与泌尿道癌、膀胱癌的发生有密切关联,请根据上述信息回答下列问题:(1)、马兜铃酸(C17H11NO7)由 种元素组成;(2)、据此列式计算马兜铃酸中的C、H、N、O元素的质量比;(3)、氧元素的质量分数30. 兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾则:(1)、在滴加的过程中,烧杯中溶液的pH逐渐(填“增大”、“减小”或“不变”).(2)、从现象可知,镁条和盐酸反应是(填“放热”或“吸热”)反应.(3)、当镁条还有剩余时,溶液中的溶质是(填化学式).31. 已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳,.某化学兴趣小组用如图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量).

实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
回答下列问题:
(1)、仪器①的名称是;(2)、能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且;(3)、若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a b(填“>”“=”或“<”);(4)、D处为收集尾气的装置,应选择装置(填“甲”“乙”或“丙”)32. 电梯的简化模型如下图甲所示。考虑安全、舒适、省时等因素,电梯速度要经过增大、不变和减小的过程,这一过程是通过改变拉力大小来实现的。某次上升过程中电梯所受拉力F随上升高度h变化的图象如下图乙所示,这个过程用时1分钟。求在这个过程中: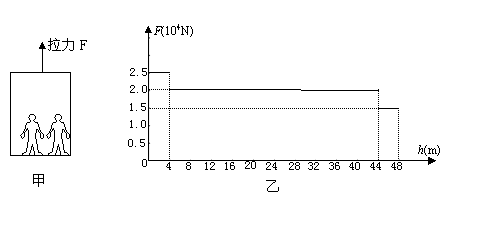 (1)、电梯上升的平均速度;(2)、拉力做的总功;(3)、拉力做功的平均功率。33. 下图是“×××”补钙商品标签图.请根据标签信息完成下列两题:
(1)、电梯上升的平均速度;(2)、拉力做的总功;(3)、拉力做功的平均功率。33. 下图是“×××”补钙商品标签图.请根据标签信息完成下列两题: (1)、该药片中属于有机化合物的是
(1)、该药片中属于有机化合物的是
(2)、列式计算每片药剂中至少含钙元素的质量.(3)、小明为测定其碳酸钙的含量标注是否属实,他取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应.)通过计算判断钙片中碳酸钙的含量标注是否属实.34. 有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。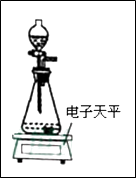
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如下表:
反应前总质量m1
反应后总质量m2
371.84g
371.24g
回答下列问题:
(1)、配平化学方程式:2Al+2NaOH+2H2O====(加热) NaAlO2+3H2↑(2)、根据化学方程式计算样品中铝的质量分数。(3)、以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有 。A、向锥形瓶中倒入样品时,撒出了部分粉末 B、在反应过程中有水蒸气逸出 C、没有等装置中氢气全部排尽就称量35. 氢氧化钠固体为什么要密封保存?对长时间搁置于空气中的氢氧化钠固体,如何检验它是否已经变质?