(浙教版)九年级科学上册专项知识点:物质转化
试卷更新日期:2024-09-27 类型:同步测试
一、选择题
-
1. 下列转化不能通过一步反应实现的是( )A、Fe2O3→Fe B、CO2→CO C、NaNO3→NaCl D、CO2→CaCO32. 在一定条件下,下列物质间的转化能一步实现的是( )A、 B、 C、 D、3. 某无色溶液中若含有大量Na2SO4、Na2CO3、NaOH,为验证其中所含的阴离子,若限定只取一次待测液,加入试剂顺序正确的是( )A、盐酸、BaCl2、酚酞 B、BaCl2、盐酸、酚酞 C、BaCl2、酚酞、盐酸 D、酚酞、盐酸、BaCl24. 读碳和碳的化合物间的转化关系图,下列有关说法正确的是( )
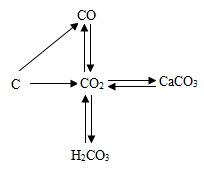 A、“C→CO”的反应中碳发生还原反应 B、“CO→CO2“的反应类型为置换反应 C、“CO2→CaCO3"的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试液验证5. 小乐利用如图所示装置和药品进行实验。实验时,先加热炭粉,一段时间后,将酒精喷灯移至CuO处加热,最终CuO变为紫红色固体。下列分析错误的是( )
A、“C→CO”的反应中碳发生还原反应 B、“CO→CO2“的反应类型为置换反应 C、“CO2→CaCO3"的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试液验证5. 小乐利用如图所示装置和药品进行实验。实验时,先加热炭粉,一段时间后,将酒精喷灯移至CuO处加热,最终CuO变为紫红色固体。下列分析错误的是( ) A、装置中气球的作用:收集尾气、防止污染空气 B、反应过程中,CuO变为Cu C、反应过程中,体现出炭粉具有还原性 D、装置中发生的反应:C+2CuO2Cu+CO2↑6. 如图所示为小乐利用浓硫酸、水、锌粒和氧化铜等药品完成氢气还原氧化铜实验所进行的一些操作,下列关于实验操作中先后顺序的叙述,错误的是( )
A、装置中气球的作用:收集尾气、防止污染空气 B、反应过程中,CuO变为Cu C、反应过程中,体现出炭粉具有还原性 D、装置中发生的反应:C+2CuO2Cu+CO2↑6. 如图所示为小乐利用浓硫酸、水、锌粒和氧化铜等药品完成氢气还原氧化铜实验所进行的一些操作,下列关于实验操作中先后顺序的叙述,错误的是( ) A、稀释浓硫酸:先将水加入烧杯中,再将浓硫酸沿烧杯壁缓缓注入水中 B、制备氢气:组装好实验装置后,先检查装置的气密性,再添加药品 C、氢气还原氧化铜开始时:先通一段时间的氢气,再点燃酒精灯进行加热 D、氢气还原氧化铜结束时:先停止通氢气,再加热一段时间后熄灭酒精灯7. 如图所示为甲、乙、丙三种物质的转化关系(“→”表示反应一步实现,反应条件略去),下列各组物质中不能实现该转化关系的是( )
A、稀释浓硫酸:先将水加入烧杯中,再将浓硫酸沿烧杯壁缓缓注入水中 B、制备氢气:组装好实验装置后,先检查装置的气密性,再添加药品 C、氢气还原氧化铜开始时:先通一段时间的氢气,再点燃酒精灯进行加热 D、氢气还原氧化铜结束时:先停止通氢气,再加热一段时间后熄灭酒精灯7. 如图所示为甲、乙、丙三种物质的转化关系(“→”表示反应一步实现,反应条件略去),下列各组物质中不能实现该转化关系的是( )
甲
乙
丙
A
B
C
D
A、A B、B C、C D、D8. 常温下,下列各组物质中,乙既能与甲反应又能与丙反应的是( )选项
物质甲
物质乙
物质丙
A
B
C
D
A、A B、B C、C D、D9. 某无色无味的干燥气体通过甲装置后使红棕色的氧化铁粉末变黑。小明猜测该气体可能是氢气、一氧化碳中的一种或两种。为验证猜测,小明从图乙中选择装置和对应药品,并按一定次序连接在甲装置的后面,其中装置和药品选择及装置连接次序最好的是( ) A、①②③⑤ B、①③②⑤ C、①④②⑤ D、③①②⑤10. 如图为CO还原CuO“微型”实验装置(夹持仪器等略),已知:HCOOHH2O+CO,下列说法错误的是( )
A、①②③⑤ B、①③②⑤ C、①④②⑤ D、③①②⑤10. 如图为CO还原CuO“微型”实验装置(夹持仪器等略),已知:HCOOHH2O+CO,下列说法错误的是( ) A、实验中所需CO可现制现用 B、此装置可节约用品,污染小,现象明显 C、本实验中可以观察到黑色固体变红,澄清石灰水变浑浊 D、该实验中CO是还原剂,发生了还原反应11. 如图是自然界中碳、氧循环简图(X为H2CO3 , Y为C6H12O6)。下列说法不正确的是( )
A、实验中所需CO可现制现用 B、此装置可节约用品,污染小,现象明显 C、本实验中可以观察到黑色固体变红,澄清石灰水变浑浊 D、该实验中CO是还原剂,发生了还原反应11. 如图是自然界中碳、氧循环简图(X为H2CO3 , Y为C6H12O6)。下列说法不正确的是( ) A、图一中的转化1是酸雨形成的主要原因 B、图二中可实现有机物与无机物的相互转化 C、绿色植物通过光合作用,将太阳能转化成化学能 D、碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定12. 如图是初中四种常见物质之间的常见反应关系图,图中“—”表示相连的两种物质能反应,“→”表示两端的物质通过一步反应能转化。下列说法不正确的是( )
A、图一中的转化1是酸雨形成的主要原因 B、图二中可实现有机物与无机物的相互转化 C、绿色植物通过光合作用,将太阳能转化成化学能 D、碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定12. 如图是初中四种常见物质之间的常见反应关系图,图中“—”表示相连的两种物质能反应,“→”表示两端的物质通过一步反应能转化。下列说法不正确的是( ) A、X一定是Ca(OH)2 B、X与Y反应能生成NaOH C、X与Y不可能都是盐 D、Y可能是钠盐13. 钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( )
A、X一定是Ca(OH)2 B、X与Y反应能生成NaOH C、X与Y不可能都是盐 D、Y可能是钠盐13. 钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( ) A、该实验还需要增加尾气处理装置 B、加热前应先通入一段时间的 , 目的是排尽装置内的空气,防止加热时发生爆炸 C、溶液的作用是检验反应后的产物 D、反应结束后,应先停止加热,继续通入至固体冷却为止14. 小金归类整理了一些常见物质的相互转化关系(部分反应条件已省略),其中不正确的是( )
A、该实验还需要增加尾气处理装置 B、加热前应先通入一段时间的 , 目的是排尽装置内的空气,防止加热时发生爆炸 C、溶液的作用是检验反应后的产物 D、反应结束后,应先停止加热,继续通入至固体冷却为止14. 小金归类整理了一些常见物质的相互转化关系(部分反应条件已省略),其中不正确的是( ) A、利用反应①可制得 B、利用反应②可检验 C、Ⅰ中的反应说明制取氧气有多种途径 D、Ⅱ中的反应说明氧气具有还原性15. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是()
A、利用反应①可制得 B、利用反应②可检验 C、Ⅰ中的反应说明制取氧气有多种途径 D、Ⅱ中的反应说明氧气具有还原性15. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是()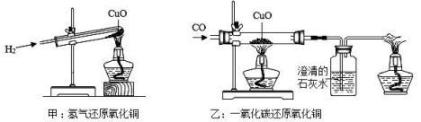 A、甲实验试管口向下倾斜可防止氢气逸出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都需尾气回收16. 取少量铁粉和硫粉混合均匀后加热。小科对产物进行如下实验(FeS+H2SO4=H2S↑+FeSO4 , H2S气体能被氢氧化钠溶液吸收,Fe3+遇硫氰化钾KSCN溶液显红色,Fe2+遇KSCN溶液不显红色)。若溶液E不显红色,则下列说法错误的是( )
A、甲实验试管口向下倾斜可防止氢气逸出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都需尾气回收16. 取少量铁粉和硫粉混合均匀后加热。小科对产物进行如下实验(FeS+H2SO4=H2S↑+FeSO4 , H2S气体能被氢氧化钠溶液吸收,Fe3+遇硫氰化钾KSCN溶液显红色,Fe2+遇KSCN溶液不显红色)。若溶液E不显红色,则下列说法错误的是( ) A、刺激性气体A为SO2 B、黑色固体B为FeS C、溶液F中的溶质为Na2S、NaOH D、气体G为H217. 一包固体粉末可能含有硝酸钠、碳酸钙、氢氧化钠、氯化铜、氯化钠和硝酸钙中的一种或几种。为确定其组成,某同学设计了如下实验方案。下列判断正确的是( )
A、刺激性气体A为SO2 B、黑色固体B为FeS C、溶液F中的溶质为Na2S、NaOH D、气体G为H217. 一包固体粉末可能含有硝酸钠、碳酸钙、氢氧化钠、氯化铜、氯化钠和硝酸钙中的一种或几种。为确定其组成,某同学设计了如下实验方案。下列判断正确的是( )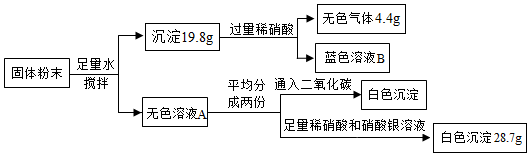 A、该混合物中一定含有碳酸钙、氢氧化钠、氯化铜、硝酸钙、氯化钠 B、蓝色溶液B呈中性 C、无色溶液A的溶质最多有3种 D、该混合物中一定不含氯化钠,可能含有硝酸钠
A、该混合物中一定含有碳酸钙、氢氧化钠、氯化铜、硝酸钙、氯化钠 B、蓝色溶液B呈中性 C、无色溶液A的溶质最多有3种 D、该混合物中一定不含氯化钠,可能含有硝酸钠二、填空题
-
18. “登高取物”游戏规则:梯子上下相邻的物质之间能发生反应的,游戏者可以上升一格, 最终登顶者可以获得“足球”奖励。甲同学根据规则能顺利获奖,乙同学根据规则从 CaCO3、CuSO4、KNO3、BaCl2 中选择合适物质填入①、②两处,也顺利获奖。
 (1)、②是。(2)、写出图中有 CuO 参加的一个化学反应方程式。19. 如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,回答下列问题:
(1)、②是。(2)、写出图中有 CuO 参加的一个化学反应方程式。19. 如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,回答下列问题: (1)、实现③转化,可以加入 溶液(填化学式)。(2)、写出实现⑥转化的化学方程式 。(3)、不能一步实现转化的是 (填序号)。20. 有一包固体样品可能是由NaOH、CaCO3、K2SO4、CuSO4、MgSO4中的一种或几种组成。某兴趣小组同学为了确定其成分,进行如图实验:
(1)、实现③转化,可以加入 溶液(填化学式)。(2)、写出实现⑥转化的化学方程式 。(3)、不能一步实现转化的是 (填序号)。20. 有一包固体样品可能是由NaOH、CaCO3、K2SO4、CuSO4、MgSO4中的一种或几种组成。某兴趣小组同学为了确定其成分,进行如图实验: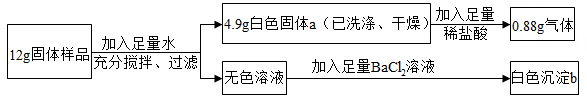 (1)、白色固体a的成分是 。(2)、固体样品中一定没有。21. 如图为氢气还原氧化铜的微型实验装置图,请分析回答:
(1)、白色固体a的成分是 。(2)、固体样品中一定没有。21. 如图为氢气还原氧化铜的微型实验装置图,请分析回答: (1)、实验过程中,能证明氧化铜被还原的实验现象是。(2)、为防止实验过程中可能引起爆炸,我们在实验开始时的操作应该是____(填序号)。A、应先加热,后挤压微型滴管 B、应先挤压微型滴管,后加热(3)、反应完成后停止加热,还要继续通入氢气,直至玻璃管冷却,目的是。22. 如图是氢气与氧化铜反应的实验装置,在实验后发现所得的固体中除有一种红色光亮物质外,还有一种砖红色物质.查阅有关资料后,发现氢气还原氧化铜的反应分两步进行:(氧化亚铜为砖红色)
(1)、实验过程中,能证明氧化铜被还原的实验现象是。(2)、为防止实验过程中可能引起爆炸,我们在实验开始时的操作应该是____(填序号)。A、应先加热,后挤压微型滴管 B、应先挤压微型滴管,后加热(3)、反应完成后停止加热,还要继续通入氢气,直至玻璃管冷却,目的是。22. 如图是氢气与氧化铜反应的实验装置,在实验后发现所得的固体中除有一种红色光亮物质外,还有一种砖红色物质.查阅有关资料后,发现氢气还原氧化铜的反应分两步进行:(氧化亚铜为砖红色)
第一步:氢气+氧化铜氧化亚铜+水
第二步:氢气+氧化亚铜铜+水
(1)、图中的实验装置有1处错误,请改正:。(2)、实验前先通一段时间氢气,然后再加热,是为了防止氢气不纯受热爆炸。由此推测氢气具有性。(3)、根据上面的反应步骤,请分析在这次实验中所得该砖红色物质的原因可能是(填序号)。①部分氧化铜没有被还原②反应中加热时间不够③通入氢气的量不足
23. 有一包白色固体,可能由 BaCl2、NaOH、Na2CO3、Na2SO4 中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。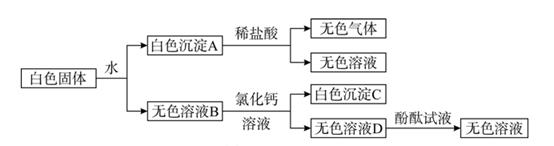 (1)、白色沉淀 A 与稀盐酸反应的化学反应方程式为。(2)、这包白色固体是由(填化学式)组成的。24. 有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠中的一种或几种组成。为检验其中的成分,按以下流程进行实验:
(1)、白色沉淀 A 与稀盐酸反应的化学反应方程式为。(2)、这包白色固体是由(填化学式)组成的。24. 有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠中的一种或几种组成。为检验其中的成分,按以下流程进行实验: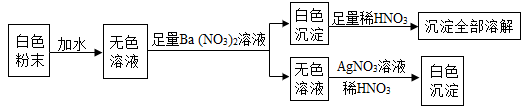 (1)、根据实验现象,白色粉末中一定有。(2)、实验中不能用BaCl2 溶液代替 Ba(NO3)2 溶液的理由是。25. 现有4包白色粉未,编号为A、B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。
(1)、根据实验现象,白色粉末中一定有。(2)、实验中不能用BaCl2 溶液代替 Ba(NO3)2 溶液的理由是。25. 现有4包白色粉未,编号为A、B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。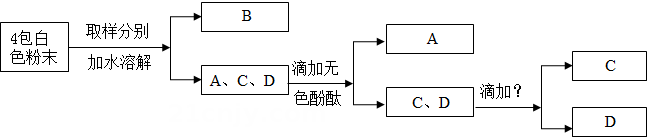 (1)、确定B是硫酸铜,该试管中看到的现象是。(2)、酚酞滴入A溶液中变红色,则A的化学式是。(3)、将 C、D 鉴别出来,“? ”代表的试剂是。
(1)、确定B是硫酸铜,该试管中看到的现象是。(2)、酚酞滴入A溶液中变红色,则A的化学式是。(3)、将 C、D 鉴别出来,“? ”代表的试剂是。三、实验探究题
-
26. 碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料。我国化学家侯德榜对制碱工业有重大贡献,他发明的制碱方法,被誉为“侯氏制碱法”,其生产工艺流程示意图如下:整个过程中涉及的主要反应有:

①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl +NaHCO3(晶体)
③2NaHCO3Na2CO3+H2O+CO2↑
请问答下列问题:
(1)、碳酸钠属于(填“酸"、“碱”或盐”)。(2)、X遇碱溶液会生成刺激性气味的气体,此气体可使紫色石蕊试液变色。若要通过实验区分X和另一种氮肥硝酸铵,常用的试剂是溶液。(3)、X是滤液中最主要的成分,X与Ca(OH)2反应的产物之一可用于该生产工艺流程的循环使用,该产物的名称为。27. 如图为气体X(纯净物)与氧化铜反应制取铜的实验装置。回答问题: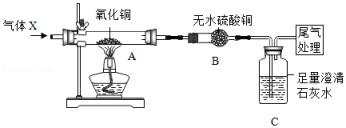 (1)、在对A中氧化铜进行加热前,需要先通一段时间的气体X,其目的是。(2)、若实验中,观察到A中黑色氧化铜粉末变红,B中无水硫酸铜无明显现象,C中澄清石灰水变浑浊,则通入的气体X为。(3)、查阅资料得知:①气体X与氧化铜反应除生成铜外还可能生成氧化亚铜(Cu2O);②铜和氧化亚铜均为不溶于水的红色固体;③Cu2O+H2SO4═CuSO4+Cu+H2O。
(1)、在对A中氧化铜进行加热前,需要先通一段时间的气体X,其目的是。(2)、若实验中,观察到A中黑色氧化铜粉末变红,B中无水硫酸铜无明显现象,C中澄清石灰水变浑浊,则通入的气体X为。(3)、查阅资料得知:①气体X与氧化铜反应除生成铜外还可能生成氧化亚铜(Cu2O);②铜和氧化亚铜均为不溶于水的红色固体;③Cu2O+H2SO4═CuSO4+Cu+H2O。小乐为了探究反应所得红色固体的成分,进行了如下实验:
实验操作
实验现象
实验结论
步骤一
取20g红色固体于烧杯中,加入足量稀硫酸
红色固体可能是氧化亚铜,也可能是铜和氧化亚铜
步骤二
将步骤一反应所得的混合物经过滤、洗涤、干燥并称量剩余红色固体质量
剩余红色固体质量为12g
20g红色固体中,铜和氧化亚铜的质量比为
28. 小明设计了如图甲所示的实验装置,进行一氧化碳还原氧化铜的实验。为分离A装置中反应排出的一氧化碳和二氧化碳,他又设计了如图乙所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞)。请回答: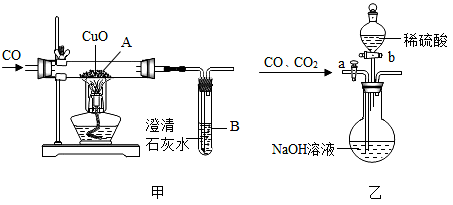 (1)、实验前先要检查装置的气密性,并检验气体的纯度,再对图甲装置进行加热,加热前还要进行的一步操作是。(2)、为分离得到CO和CO2 , 应该对图乙装置进行怎样的操作?。(3)、对A装置中反应后得到的红色固体(此时氧化铜全部反应完),小明又进行了以下探究:
(1)、实验前先要检查装置的气密性,并检验气体的纯度,再对图甲装置进行加热,加热前还要进行的一步操作是。(2)、为分离得到CO和CO2 , 应该对图乙装置进行怎样的操作?。(3)、对A装置中反应后得到的红色固体(此时氧化铜全部反应完),小明又进行了以下探究:【查阅资料】:①氧化铜经一氧化碳还原不仅能生成铜,还可能生成中间产物氧化亚铜(Cu2O);
②Cu2O是不溶于水的红色固体,能与酸发生反应,生成Cu2+和Cu。
【提出猜想】:氧化铜经一氧化碳还原所得到的红色固体中除Cu外还可能含有Cu2O。
【进行实验】:小明设计了一个最简单的实验方案:
实验步骤
取少量该红色固体放入盛有稀盐酸的试管中,振荡
实验现象及结论
四、解答题
-
29. 工业上用一氧化碳在高温下还原氧化铁来冶炼铁,某炼铁厂购进1000t含氧化铁质量分数为80%的某种矿石。请计算:(1)、1000t矿石中含氧化铁的质量。(2)、杂质不参加反应,理论上可以炼出纯铁的质量是多少?30. 黄铜(由铜和锌形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为 了测定黄铜屑样品组成,分四组取样品与稀硫酸反应,其实验数据记录如下表:
样 品
第 1 份
第2份
第3份
第4份
取样品质量(g)
25.0
25.0
25.0
25.0
取稀硫酸质量(g)
40.0
80.0
120.0
160.0
产生气体质量(g)
0.2
0.4
0.5
m
试计算:
(1)、上表中 m 的数值是;(2)、通过分析上述数据可知,当黄铜样品和稀硫酸的质量比为时,两者恰好完全 反应;(3)、求所用稀硫酸中硫酸的质量分数?31. 图甲是一氧化碳还原氧化铁的实验装置(硬质玻璃管中发生的反应可用方程式表示)。试回答下列问题: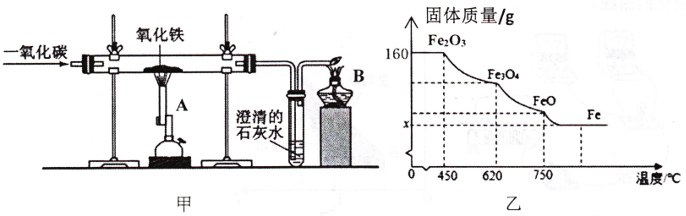 (1)、图甲实验时,①通 , ②点然酒精喷灯 , ③点燃酒精灯 , 以上三步操作的先后顺序是。(2)、氧化铁被还原时,会逐步失去氧元素。该过程中固体成分与质量随温度变化的曲线如图乙所示:
(1)、图甲实验时,①通 , ②点然酒精喷灯 , ③点燃酒精灯 , 以上三步操作的先后顺序是。(2)、氧化铁被还原时,会逐步失去氧元素。该过程中固体成分与质量随温度变化的曲线如图乙所示:①氧化铁在 ▲ 开始生成四氧化三铁。
②求出图中的值(写出计算过程)。
(3)、冶炼等质量的下列物质,能得到铁最多的是____。A、 B、 C、 D、