江苏省昆山市2024年中考化学六校联考(一模)试题
试卷更新日期:2024-06-05 类型:中考模拟
一、单项选择题(40分)
-
1. “垃圾分类工作就是新时尚”。废旧报纸应投入的垃圾箱是( )A、
 B、
B、 C、
C、 D、
D、 2. 硫在元素周期表中信息如图所示。下列有关硫元素的说法中,不正确的是:( )
2. 硫在元素周期表中信息如图所示。下列有关硫元素的说法中,不正确的是:( ) A、原子序数是16 B、元素符号为S C、相对原子质量是32.06 D、一个硫原子核外电子数为323. 下列有关空气的说法正确的是( )A、洁净的空气属于纯净物 B、工业分离液态空气时发生化学变化 C、食品在空气中因与氧气发生缓慢氧化而变质 D、空气中的二氧化碳含量过高不会对环境造成影响4. 下列相关物质中属于氧化物的是:( )A、KNO3 B、CO2 C、K2S D、C5. 下列有关物质的性质与用途对应关系正确的是( )A、石墨质软,可用作电池电极 B、氮气难溶于水,可用作保护气 C、醋酸有挥发性,可用于除水垢 D、固体氢氧化钠有吸水性,可用作干燥剂6. 下列有关CO2实验的图示正确的是()A、
A、原子序数是16 B、元素符号为S C、相对原子质量是32.06 D、一个硫原子核外电子数为323. 下列有关空气的说法正确的是( )A、洁净的空气属于纯净物 B、工业分离液态空气时发生化学变化 C、食品在空气中因与氧气发生缓慢氧化而变质 D、空气中的二氧化碳含量过高不会对环境造成影响4. 下列相关物质中属于氧化物的是:( )A、KNO3 B、CO2 C、K2S D、C5. 下列有关物质的性质与用途对应关系正确的是( )A、石墨质软,可用作电池电极 B、氮气难溶于水,可用作保护气 C、醋酸有挥发性,可用于除水垢 D、固体氢氧化钠有吸水性,可用作干燥剂6. 下列有关CO2实验的图示正确的是()A、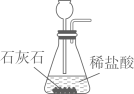 制取CO2
B、
制取CO2
B、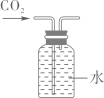 收集CO2
C、
收集CO2
C、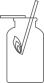 验证CO2已集满
D、
验证CO2已集满
D、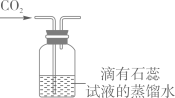 验证CO2能与水反应
7. 下列说法符合安全要求的是()A、家中燃气泄漏,立即开灯检查 B、稀释浓硫酸时,将水沿烧杯壁缓缓注入盛有浓硫酸的烧杯中 C、不慎碰倒酒精灯,洒出的酒精在桌上燃烧,立即用水浇灭 D、逃离火灾现场时,可用湿毛巾捂住口鼻,并尽量贴近地面8. 《茉莉花》是一首脍炙人口的苏南民歌。茉莉花香气的成分有多种,乙酸苯甲酯(C9H10O2)是其中的一种。下列关于乙酸苯甲酯的说法正确的是( )
验证CO2能与水反应
7. 下列说法符合安全要求的是()A、家中燃气泄漏,立即开灯检查 B、稀释浓硫酸时,将水沿烧杯壁缓缓注入盛有浓硫酸的烧杯中 C、不慎碰倒酒精灯,洒出的酒精在桌上燃烧,立即用水浇灭 D、逃离火灾现场时,可用湿毛巾捂住口鼻,并尽量贴近地面8. 《茉莉花》是一首脍炙人口的苏南民歌。茉莉花香气的成分有多种,乙酸苯甲酯(C9H10O2)是其中的一种。下列关于乙酸苯甲酯的说法正确的是( )
A、乙酸苯甲酯的相对分子质量为150g B、乙酸苯甲酯由碳、氢、氧三种元素组成 C、乙酸苯甲酯中碳、氢、氧三种元素质量比为9: 10: 2 D、乙酸苯甲酯分子由碳原子、氢原子、氧分子构成9. 下列叙述正确的是:( )A、用小苏打治疗胃酸过多 B、用氢氧化钠改良酸性土壤 C、用铁桶长时问存放硫酸铜溶液 D、用食盐水除去热水瓶中的水垢10. 右图为甲、乙两物质的溶解度曲线。下列说法的正确是:( ) A、甲、乙两物质均属于难溶物质 B、甲物质的溶解度大干乙物质的溶解度 C、t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等 D、t2℃时,甲物质饱和溶液的溶质质量分数为50%11. 分析和推理是化学学习中常用的思维方法。下列因果关系完全正确的一组是:( )A、洗洁精能够洗去餐具上的油污,是因为洗洁精能够溶解油污 B、饱和澄清石灰水受热后变浑浊,是因为氢氧化钙的溶解度随温度升高而增大 C、碳酸钠溶液能使无色酚酞试液变红,是因为碳酸钠属于碱类物质 D、氯化銨与草木灰不能混合施用,是困为銨态氮肥与碱性物质混合产生氨气,降低肥效12. 如果配制6%的氯化钠溶液的溶质质量分数偏小,其原因是( )A、称取的氯化钠固体质量偏大 B、转移称量好的氯化钠固体时,有少量洒落在桌面上 C、量取水的体积偏小 D、转移配制好的溶液时,有少量液体溅出13. 下列有关物质混合后的现象描述中,正确的是( )A、在无色碘化钾溶液中滴加淀粉溶液,溶液变蓝 B、无色的氯化氢气体和氨气混合,产生白雾 C、在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,产生蓝色絮状沉淀 D、铵盐与碱溶液混合加热,产生的气体使湿润的蓝色石蕊试纸变红14. 下列除去杂质(在括号内)选用的方法(在箭头右侧)正确的是:( )A、CO2气体(CO) B、MnO2固体(KCl) C、CO2气体(HCl) D、KCl溶液(K2CO3)15. 下列说法中正确的是:( )A、向鸡蛋清溶液中加入饱和硫酸铵溶液出现白色沉淀 B、氯化钠固体中混有少量硝酸钾固体,可用降温结晶的方法除去硝酸钾 C、氢氧燃料电池可以将电能直接转化为化学能 D、饱和石灰水溶液放置较长时间后表面形成了一层白膜(若水没有减少),该溶液仍是氢氧化钙的饱和溶液16. 下列各组变化中,每个转化在一定条件下均能一步实现的是( )
A、甲、乙两物质均属于难溶物质 B、甲物质的溶解度大干乙物质的溶解度 C、t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等 D、t2℃时,甲物质饱和溶液的溶质质量分数为50%11. 分析和推理是化学学习中常用的思维方法。下列因果关系完全正确的一组是:( )A、洗洁精能够洗去餐具上的油污,是因为洗洁精能够溶解油污 B、饱和澄清石灰水受热后变浑浊,是因为氢氧化钙的溶解度随温度升高而增大 C、碳酸钠溶液能使无色酚酞试液变红,是因为碳酸钠属于碱类物质 D、氯化銨与草木灰不能混合施用,是困为銨态氮肥与碱性物质混合产生氨气,降低肥效12. 如果配制6%的氯化钠溶液的溶质质量分数偏小,其原因是( )A、称取的氯化钠固体质量偏大 B、转移称量好的氯化钠固体时,有少量洒落在桌面上 C、量取水的体积偏小 D、转移配制好的溶液时,有少量液体溅出13. 下列有关物质混合后的现象描述中,正确的是( )A、在无色碘化钾溶液中滴加淀粉溶液,溶液变蓝 B、无色的氯化氢气体和氨气混合,产生白雾 C、在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,产生蓝色絮状沉淀 D、铵盐与碱溶液混合加热,产生的气体使湿润的蓝色石蕊试纸变红14. 下列除去杂质(在括号内)选用的方法(在箭头右侧)正确的是:( )A、CO2气体(CO) B、MnO2固体(KCl) C、CO2气体(HCl) D、KCl溶液(K2CO3)15. 下列说法中正确的是:( )A、向鸡蛋清溶液中加入饱和硫酸铵溶液出现白色沉淀 B、氯化钠固体中混有少量硝酸钾固体,可用降温结晶的方法除去硝酸钾 C、氢氧燃料电池可以将电能直接转化为化学能 D、饱和石灰水溶液放置较长时间后表面形成了一层白膜(若水没有减少),该溶液仍是氢氧化钙的饱和溶液16. 下列各组变化中,每个转化在一定条件下均能一步实现的是( ) A、①② B、①③ C、②③ D、①②③17. 下列对实验操作或现象的描述正确的是:( )A、铁丝在空气中燃烧生成黑色固体 B、浓硝酸滴入鸡蛋清,蛋清凝固变白 C、为加速过滤,将待过滤的悬浊液先静置 D、食盐水蒸发结晶将液体蒸干再停止加热18. 下列实验方案不能达到目的的是( )A、鉴别:用熟石灰鉴别NH4Cl固体和NH4NO3固体 B、除杂:用浓硫酸除去O2中混有的少量水蒸气 C、检验:用高锰酸钾溶液检验CO2中是否混有SO2 D、制备:实验室用锌粒和稀硫酸制备少量H219. 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的锌粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气泡产生。则下列有关说法中,正确的是:( )A、滤出的固体中一定含有银和铜,一定不含锌。 B、滤出的固体中一定含有银,可能含有铜和锌。 C、滤液中一定含有硝酸锌,一定没有硝酸银和硝酸铜。 D、滤液中一定含有硝酸锌,可能有硝酸银和硝酸铜。20. 用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是:( )A、甲中逸出的气体只含CO2 B、乙中液体变红,证明CO2能与水反应 C、加热后红色不褪去,说明碳酸受热不分解 D、欲达到实验目的,可将盐酸改为稀硫酸
A、①② B、①③ C、②③ D、①②③17. 下列对实验操作或现象的描述正确的是:( )A、铁丝在空气中燃烧生成黑色固体 B、浓硝酸滴入鸡蛋清,蛋清凝固变白 C、为加速过滤,将待过滤的悬浊液先静置 D、食盐水蒸发结晶将液体蒸干再停止加热18. 下列实验方案不能达到目的的是( )A、鉴别:用熟石灰鉴别NH4Cl固体和NH4NO3固体 B、除杂:用浓硫酸除去O2中混有的少量水蒸气 C、检验:用高锰酸钾溶液检验CO2中是否混有SO2 D、制备:实验室用锌粒和稀硫酸制备少量H219. 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的锌粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气泡产生。则下列有关说法中,正确的是:( )A、滤出的固体中一定含有银和铜,一定不含锌。 B、滤出的固体中一定含有银,可能含有铜和锌。 C、滤液中一定含有硝酸锌,一定没有硝酸银和硝酸铜。 D、滤液中一定含有硝酸锌,可能有硝酸银和硝酸铜。20. 用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是:( )A、甲中逸出的气体只含CO2 B、乙中液体变红,证明CO2能与水反应 C、加热后红色不褪去,说明碳酸受热不分解 D、欲达到实验目的,可将盐酸改为稀硫酸二、非选择题(60分)
-
21. 化学与人类生活息息相关。请回答下列问题。(1)、生活中鉴别羊毛线和棉线的方法是。(2)、可用(填名称)来检验大米、面粉等食物中是否含有淀粉。(3)、长期饮用硬水对人体健康不利。生活中降低水的硬度可采用的方法是。(4)、铁元素是人体必需的一种微量元素。食用“加铁酱油”可预防。(5)、炒菜时油锅中的油不慎着火,用锅盖将其盖灭的原理是。(6)、人体所需的六大营养物质是。22. 如图归纳出了盐酸与其它物质间相互反应的关系(图中横线表示相连的两种物质能发生反应)。
 (1)、若X是与其它三种不同类别的物质,则X可以是(填化学式) 。(2)、根据右图所示物质间关系,写出X和盐酸反应的化学方程式:。23. 某兴趣小组制取氧气,并尝试回收部分药品。可能用到的部分装置如图。
(1)、若X是与其它三种不同类别的物质,则X可以是(填化学式) 。(2)、根据右图所示物质间关系,写出X和盐酸反应的化学方程式:。23. 某兴趣小组制取氧气,并尝试回收部分药品。可能用到的部分装置如图。 (1)、上图中仪器a的名称是。(2)、用双氧水和MnO2制氧气。发生反应的化学方程式为 , 收集氧气的装置可选用(填字母)。(3)、加热KClO3固体制氧气(1.5gMnO2作催化剂),并对KClO3完全分解后的残留固体进行分离。(已知反应原理为:)
(1)、上图中仪器a的名称是。(2)、用双氧水和MnO2制氧气。发生反应的化学方程式为 , 收集氧气的装置可选用(填字母)。(3)、加热KClO3固体制氧气(1.5gMnO2作催化剂),并对KClO3完全分解后的残留固体进行分离。(已知反应原理为:)①发生装置应选用(填字母)。
②KCl的溶解度曲线如图所示。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲将KCl全部溶解,至少应加入该温度下蒸馏水的体积约(填字母)。

a.5 mL b.10 mL c.20 mL d.30 mL
③对溶解所得混合物进行过滤,滤渣经处理得MnO2。从滤液中获得KCl晶体的最佳方法是。
24. 为认识酸和碱的性质,某化学学习小组进行了如下实验。(1)、20℃时,配制80g溶质质量分数为10%的NaOH溶液。
①用图中仪器完成实验,还缺少的玻璃仪器是(填名称);玻璃棒在配制实验中的作用是。
②配制该溶液需要g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数10%。(填“大于”或“小于”)
(2)、向1~5号小试管中分别滴加少量稀盐酸
①中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn(填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为。
(3)、借助传感器对稀NaOH溶液与稀盐酸的中和反应进行研究,实验装置如图,三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液。


①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是 , 实验进行到60s时溶液中的溶质为(填化学式)。
②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中能量的结论(填“吸收”或“释放”)。
25. 食盐是一种重要的化工原料。请回答下列问题。(1)、请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和。
②在蒸发过程中,待时,停止加热,利用余热将滤液蒸干。
(2)、由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是.(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有(用化学式表示)。
(3)、若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是。已知:20 ℃时氯化钠的溶解度为36g。26. 关于实验的探究【实验1】:
二氧化碳的捕集和资源化利用是“碳中和”领域研究热点。捕集烟气中CO2 , 将其再释放出来可实现资源化利用,相关物质转化如下:
 (1)、将CO2资源化利用,可减弱效应。(2)、“颗粒反应室”中反应的化学方程式为。(3)、上述流程中可循环使用的物质有(填化学式)。(4)、中国科学家已实现由CO2到淀粉的全人工合成,主要过程如下:
(1)、将CO2资源化利用,可减弱效应。(2)、“颗粒反应室”中反应的化学方程式为。(3)、上述流程中可循环使用的物质有(填化学式)。(4)、中国科学家已实现由CO2到淀粉的全人工合成,主要过程如下:
①阶段Ⅰ反应的微观过程如图1所示。写出该反应生成甲醇(CH3OH)的化学方程式:。

②阶段Ⅱ的物质转化如图2所示。反应a中四种物质的化学计量数均为1。推测每个分子中氢原子数目:甲醛甲醇(填“>”、“=”或“<”)。
(5)、【实验2】:分别将极稀的盐酸逐滴滴入试管甲和试管乙中,边滴边振荡。
现象为:①试管甲中的溶液开始时显浅红色,逐滴滴入稀盐酸立即有气泡产生,浅红色逐渐消失。②试管乙中的溶液开始时显红色,滴入稀盐酸没有气泡产生,溶液颜色逐渐变为浅红色后,继续滴加稀盐酸有气泡产生,浅红色逐渐消失。


【反思】在【实验3】碳酸钠溶液中逐滴滴入稀盐酸,为何刚开始没有气泡产生?研究小组查阅资料,绘制出微观示意图。
①结合图示,用化学方程式解释刚开始没有气泡的原因。
②相同浓度的碳酸氢钠溶液和碳酸钠溶液的碱性:碳酸氢钠碳酸钠(填“>”、“<”或“=”)。
(6)、在检验氢氧化钠是全部变质还是部分变质时, 加入少量稀盐酸无气泡, 能不能说明氢氧化钠没有变质?并解释原因?洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215.6g。试计算下列问题:
已知:洁厕灵有效成分是HCl,洁厕灵中其他成分均不跟NaHCO3反应。
①该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程)
②该实验中,你认为NaHCO3溶液加入“足量”对测定结果(填“有”或“无”)影响。
(7)、【实验3】:【实验操作】:向试管中加入5粒石灰石,倾倒约试管体积三分之一的稀盐酸(1:1);观察不到气泡后,仍有固体剩余;将试管静置。
取上层清液,用pH试纸测得溶液pH=2,说明溶液显性;
pH测定中,“上层清液滴到试纸上”的后一步操作是。
(8)、【实验思考Ⅰ】反应剩余液中有哪些物质?其中能使溶液pH=2的有哪些?【实验探究Ⅰ】甲同学通过实验排除了CaCl2的可能性。简述其实验方案。
(9)、乙同学将CO2通入蒸馏水中至饱和,测得pH>5。综合甲、乙两同学实验,得出的结论是:剩余液中还含有。
(10)、【实验思考Ⅱ】试管中剩余固体是否含有CaCO3?【实验探究Ⅱ】小组同学向试管中继续加入稀盐酸(1:1),又有大量气泡产生。
由此得出的结论是 , 写出该反应的化学方程式。
(11)、比较稀盐酸加入前后的实验现象,“又有大量气泡产生”的原因。(12)、【扩展延伸】反应剩余液放置一段时间后,溶液pH增大,原因是。