江苏省盐城市东台市2024年中考化学一模试卷
试卷更新日期:2024-05-31 类型:中考模拟
一、选择题((本题共15题,每小题只有一个选项符合题意,每小题2分,共30分)
-
1. 下列古代工艺主要发生化学变化的是( )A、活字印刷 B、海水晒盐 C、彩陶烧制 D、机杆织布2. 下列几种常见的饮料中不含有机物的是( )A、矿泉水 B、牛奶 C、果汁 D、啤酒3. 化学观念是化学学科核心素养的重要内容.下列说法正确的是( )A、利用化学反应可以改变原子的种类和数目 B、饱和溶液比不饱和溶液含溶质更多 C、物质的结构影响性质,性质影响用途 D、不同元素种类之间的本质区别是中子数不同4. 在配制稀硫酸并制备氢气的实验中,下列装置和实验操作正确并规范的是( )A、量取浓硫酸
 B、稀释浓硫酸
B、稀释浓硫酸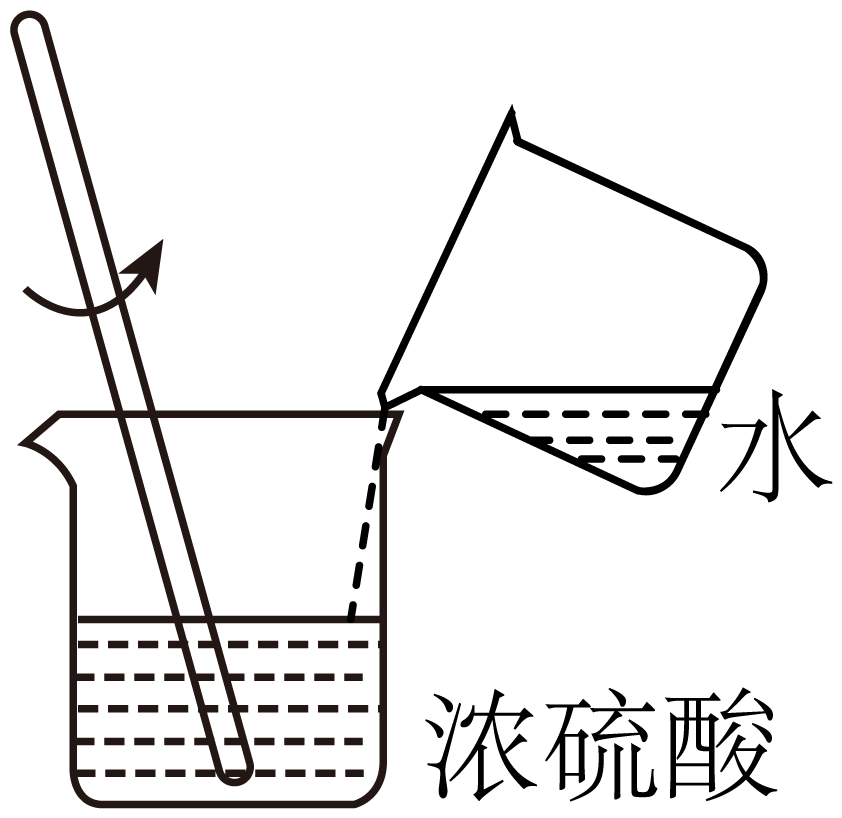 C、制取氢气
C、制取氢气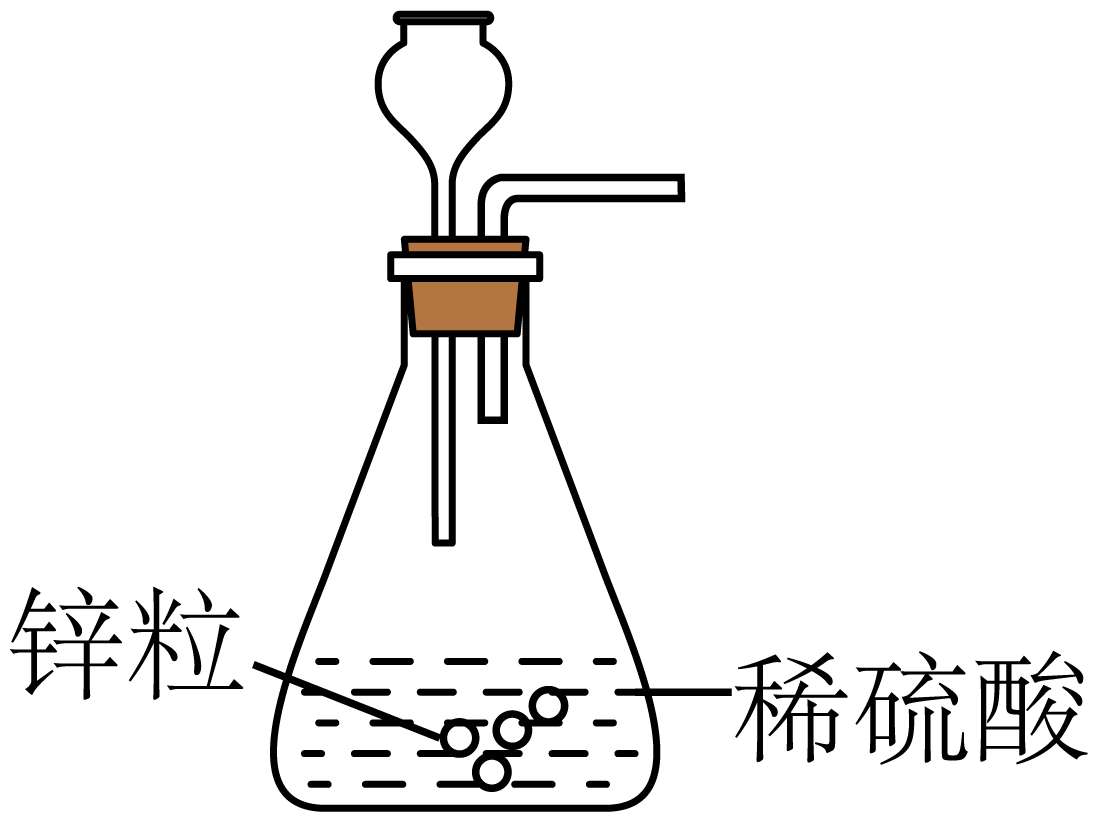 D、干燥氢气
D、干燥氢气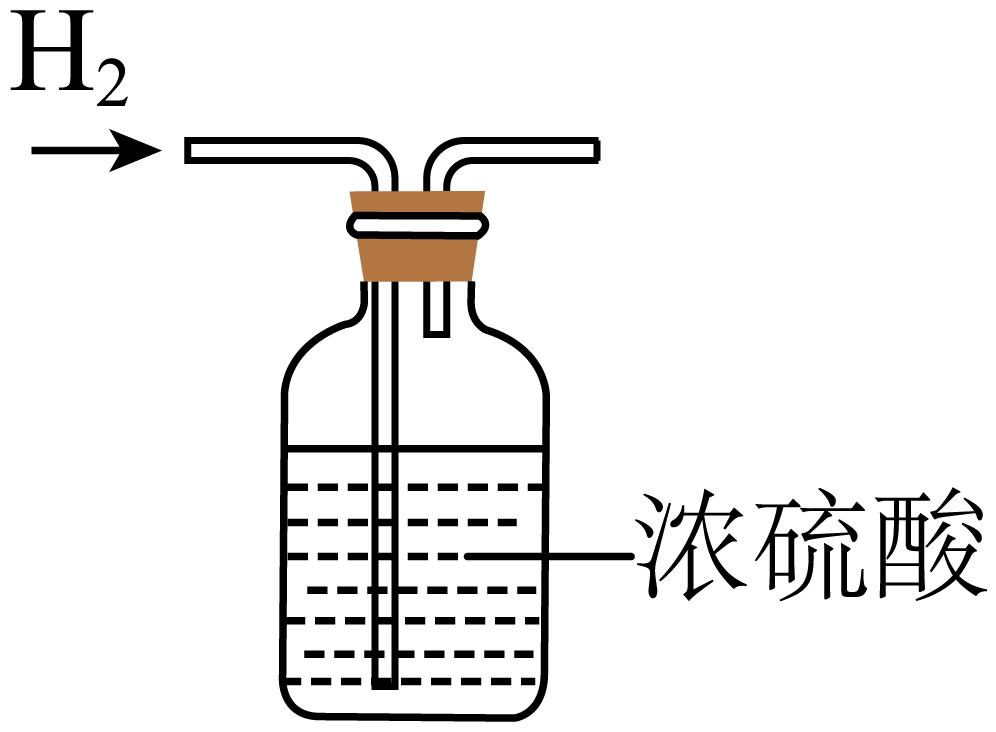 5. 黄海森林公园含丰富的负氧离子,空气中氧分子得到电子就能形成负氧离子 . 下列关于与的说法,错误的是( )A、与的化学性质不同 B、与的电子总数不同 C、与的质子数不同 D、与的相对原子质量之和相同6. 阅读下列材料,回答问题
5. 黄海森林公园含丰富的负氧离子,空气中氧分子得到电子就能形成负氧离子 . 下列关于与的说法,错误的是( )A、与的化学性质不同 B、与的电子总数不同 C、与的质子数不同 D、与的相对原子质量之和相同6. 阅读下列材料,回答问题我国古代巨著《天工开物》、《梦溪笔谈》广泛地记载了关于自然科学和社会科学的成就.前者被誉为“中国17世纪的工艺百科全书”,后者被誉为“中国科学史上的里程碑”.
(1)、《天工开物》中关于宝石的部分记载如下:“凡水晶出深山穴内瀑流石醇之中”.水晶的主要成分是 , 其结构与金刚石类似,下列关于水晶的说法错误的是( )A、水晶属于混合物 B、硬度较高 C、难溶于水 D、常温下化学性质不稳定(2)、《天工开物》中有“凡研硝不以铁碾入石臼,相激火生,则祸不可测”的记载,这里的硝主要成分是 , 也可以作肥料,下列化肥的种类与其相同的是( )A、 B、 C、 D、(3)、《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧.挹其水熬之则成胆矾(硫酸铜晶体).熬胆矾铁釜,久之亦化为铜.”下列叙述错误的是( )A、“流以为涧”中清澈的“苦泉”——溶液 B、“挹其水熬之”——蒸发溶剂 C、“熬胆矾铁釜,久之亦化为铜”——铁比铜活泼 D、“挹其水熬之则成胆矾”后剩余的“苦泉”——不饱和溶液7. 科学家设计了“人造树叶”模拟光合作用,其装置和反应的微观示意图如图.下列说法错误的是( ) A、该设计为“碳中和”提供了新途径 B、该反应共涉及三种单质 C、参加反应的与的质量比为 D、反应前后各元素的化合价均改变8. 纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验.下列说法错误的是( )
A、该设计为“碳中和”提供了新途径 B、该反应共涉及三种单质 C、参加反应的与的质量比为 D、反应前后各元素的化合价均改变8. 纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验.下列说法错误的是( ) A、水可防止生成物溅落炸裂瓶底 B、气球先膨胀后又变小 C、纳米铁粉燃烧反应的化学方程式为: D、对比细铁丝在空气中不能燃烧,可知燃烧的现象与物质的聚集状态有关9. 在和的混合物中加入一定量的稀硫酸,微热,待反应停止后过滤,滤出不溶物后再往滤液里加入一枚铁钉,若铁钉无变化,则错误的叙述是( )A、不溶物中一定有铜 B、不溶物可能是纯净物 C、滤液是硫酸亚铁溶液 D、滤液中可能有两种溶质10. 以为原料制取炭黑的太阳能工艺如图所示.下来说法正确的是( )
A、水可防止生成物溅落炸裂瓶底 B、气球先膨胀后又变小 C、纳米铁粉燃烧反应的化学方程式为: D、对比细铁丝在空气中不能燃烧,可知燃烧的现象与物质的聚集状态有关9. 在和的混合物中加入一定量的稀硫酸,微热,待反应停止后过滤,滤出不溶物后再往滤液里加入一枚铁钉,若铁钉无变化,则错误的叙述是( )A、不溶物中一定有铜 B、不溶物可能是纯净物 C、滤液是硫酸亚铁溶液 D、滤液中可能有两种溶质10. 以为原料制取炭黑的太阳能工艺如图所示.下来说法正确的是( ) A、反应1中黑色粉末变红 B、反应2的基本类型为置换反应 C、该工艺可实现太阳能与化学能的相互转化 D、该工艺可实现的捕集、转化和利用11. 下列实验操作能达到实验目的的是( )
A、反应1中黑色粉末变红 B、反应2的基本类型为置换反应 C、该工艺可实现太阳能与化学能的相互转化 D、该工艺可实现的捕集、转化和利用11. 下列实验操作能达到实验目的的是( )选项
物质
目的
主要实验操作
A
鉴别
点燃,在火焰上方罩一个干冷的烧杯,观察现象
B
中混有少量
除杂
充分溶解、过滤、洗涤、干燥
C
与中和后,盐酸是否有剩余
检验
取样,滴加溶液,观察有无沉淀
D
和的混合溶液
分离
先加入过量的溶液,搅拌、静置、过滤、洗涤,再分别向滤液、滤渣中加入适量的稀硝酸,搅拌
A、A B、B C、C D、D12. “侯氏联合制碱法”的主要反应是 . 下图三种固体物质的溶解度曲线,下列说法正确的是( ) A、时,溶液比溶液的溶质质量分数小 B、时,水中加入固体和固体,一定有晶体析出 C、若固体中含有少量 , 可用蒸发结晶的方法提纯 D、该实验成功的关键是时在水中的溶解度比要小的多13. 如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得 . 下列对导致这一结果的原因的分析中,一定错误的是( )
A、时,溶液比溶液的溶质质量分数小 B、时,水中加入固体和固体,一定有晶体析出 C、若固体中含有少量 , 可用蒸发结晶的方法提纯 D、该实验成功的关键是时在水中的溶解度比要小的多13. 如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得 . 下列对导致这一结果的原因的分析中,一定错误的是( ) A、Ⅰ、Ⅱ装置之间缺少干燥装置 B、没有全部被还原 C、Ⅱ装置中玻璃管内有水冷凝 D、Ⅲ装置后缺少干燥装置
A、Ⅰ、Ⅱ装置之间缺少干燥装置 B、没有全部被还原 C、Ⅱ装置中玻璃管内有水冷凝 D、Ⅲ装置后缺少干燥装置二、非选择题(本题共4小题,共40分)
-
14. 2023年5月30日“神舟十六号”太空飞船成功发射,标志着我国载人航天进入新的发展阶段.
Ⅰ.航天材料
(1)、航天员舱外航天服使用的聚氨酯橡胶是(填“隔热”或“导热”)材料.(2)、太阳能电池板需要使用铝合金箔片,铝合金属于(填“纯净物”或“混合物”),铝合金的硬度比纯铝(填“大”或“小”),它能加工成箔片是利用了金属的性.(3)、Ⅱ.生命保障航天食品中包含牛肉和蔬菜,其中主要为航天员提供维生素C的食品是 .
(4)、太空舱的氧气主要来自于水的电解,电解水反应的化学方程式为 .(5)、Ⅲ.能源系统长征型火箭使用的推进剂为偏二甲肼和四氧化二氮.
①四氧化二氮中,氮元素的化合价为 .
②偏二甲肼与四氧化二氮反应过程中(填“吸收”或“放出”)热量.
15. 某小组开展课外兴趣实验探究.回答下列问题.
A B C D E
(1)、装置B中仪器①的名称是 .(2)、实验室用石灰石和制取二氧化碳,选用发生装置(填装置序号),反应的化学方程式为 .(3)、为了制得二氧化碳的水溶液,二氧化碳应从装置C的(填“m”或“n”)端通入.(4)、小明将二氧化碳的水溶液转移至烧杯,并组装装置D,置于阳光下一段时间,观察到有和现象产生,是因为二氧化碳和水在生物体内发生了化学反应,生成了葡萄糖和一种单质,这种单质为 .(5)、小茜设计了一个趣味实验装置E,其气密性良好.若要使尖嘴导管有“喷泉”产生,则烧瓶中加入的固体和液体不可能的是____.A、锌和稀硫酸 B、硝酸铵和水 C、二氧化锰和过氧化氢溶液 D、生石灰和水16. 碲广泛用于彩色玻璃和陶瓷工艺.以某工业废渣(主要含有 , 少量)为原料制备碲的一种工艺流程如图:
资料:①不与稀硫酸或氢氧化钠溶液反应.
②能与较浓的碱溶液反应.
③可溶解在酸性较强的酸溶液中.
(1)、请类比与的反应,写出“碱浸”时发生反应的化学方程式 .(2)、“碱浸”后过滤得到的滤渣成分为 .(3)、“沉碲”时,缓慢加入硫酸降低至之间,不断搅拌生成沉淀,不能降太低的原因是 .(4)、“酸溶”后,在溶液中通入 , 反应生成固体和 , 则该反应的化学方程式是 .(5)、若测得废渣中的含量为80%,则每千克废渣通过这一流程可以提炼出单质碲的质量是(不考虑元素损失).17. 碳酸钠俗称纯碱或苏打,在生活、生产和实验研究中均有广泛应用.【制取碳酸钠】工业上以半水煤气(主要成分是和)、食盐等为原料制取纯碱的流程如图1:

图1 图2 图3
(1)、步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了转化,化学方程式是 .(2)、流程中循环利用的物质有和 .(3)、实验室从混合气体中分离出的实验装置如图2所示.广口瓶中盛放足量的浓 , 作用是 . 待混合气体从b导管口排出一段时间后,关闭活塞 , 打开活塞 , 将分液漏斗中的溶液滴加到广口瓶中,收集最终气体.(4)、【配制溶液】若配制溶质质量分数4%的溶液,下列操作正确的是(填字母).
A.用托盘天平称取固体
B.选用量筒量取所需体积的水
C.将配好的溶液装入带玻璃塞的试剂瓶中,并贴好标签
D.实验中用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、试剂瓶
(5)、【标定浓度】测定待测盐酸的溶质质量分数将固体在干燥至恒重,准确称取无水于锥形瓶中,加入蒸馏水溶解,滴入待测盐酸.当两者恰好完全反应时,消耗盐酸的体积为(该盐酸的密度近似为 , 反应中所含的碳元素全部转化为).
①计算待测盐酸的溶质质量分数.(写出计算过程)
②若上述测定过程中固体未经充分干燥,则测出盐酸的溶质质量分数将(填“偏大”、“偏小”或“无影响”).
(6)、【制备物质】工业上可用溶液吸收硫酸厂尾气中的制备无水 , 达到减少污染、节约资源的目的.反应过程中溶液组成变化图3所示.
①吸收初期(图3中通入废气体积以前)反应的化学方程式为 .
②不断通入 , 最终产物是(填化学式).