广西南宁市马山县周鹿中学2023-2024学年高一下学期化学期中考试
试卷更新日期:2024-05-22 类型:期中考试
一、选择题:本题共13小题,每小题3分,共39分。每小题只有一个选项符合题目要求。
-
1. 朱自清在《荷塘月色》中描绘了月光穿过薄雾形成缕缕光束美景,产生这种美景本质原因是( )A、水边夜色本身就很美 B、颗粒直径约为的小水滴分散在空气中 C、光线是一种胶体 D、烟雾是一种胶体,能产生丁达尔现象2. 某兴趣小组用和浓盐酸制取氯气并探究氯、溴、碘的相关性质,设计装置图如图所示(夹持装置已略去)。已知:①氧化性:;②酸性条件下,被还原为。下列说法错误的是( )
 A、装置A中发生反应的离子方程式: B、若装置C发生堵塞,B中长颈漏斗内液面会上升 C、为验证氯气是否具有漂白性,Ⅰ、Ⅱ、Ⅲ处分别放置湿润的有色布条、无水氯化钙、干燥的有色布条 D、通入足量的氯气,打开E的活塞,将溶液滴入D中,锥形瓶下层液体呈紫色即证明氧化性3. 已知A为常见的金属单质,根据如图所示的关系,下列叙述中正确的是( )
A、装置A中发生反应的离子方程式: B、若装置C发生堵塞,B中长颈漏斗内液面会上升 C、为验证氯气是否具有漂白性,Ⅰ、Ⅱ、Ⅲ处分别放置湿润的有色布条、无水氯化钙、干燥的有色布条 D、通入足量的氯气,打开E的活塞,将溶液滴入D中,锥形瓶下层液体呈紫色即证明氧化性3. 已知A为常见的金属单质,根据如图所示的关系,下列叙述中正确的是( ) A、A为Fe,B为FeO B、C→D溶液的颜色变化:浅绿色→棕黄色 C、④的离子方程式: D、⑤的离子方程式:4. 用中子轰击原子产生α粒子(即氦核)的核反应为:。已知元素Y在化合物中呈+1价。下列说法中正确的是( )A、可用于中和溅在皮肤上的NaOH溶液 B、Y单质在空气中燃烧的产物是 C、X和氢元素形成离子化合物 D、和互为同素异形体5. 下列关于不同价态含硫物质的转化实验,合理的是
A、A为Fe,B为FeO B、C→D溶液的颜色变化:浅绿色→棕黄色 C、④的离子方程式: D、⑤的离子方程式:4. 用中子轰击原子产生α粒子(即氦核)的核反应为:。已知元素Y在化合物中呈+1价。下列说法中正确的是( )A、可用于中和溅在皮肤上的NaOH溶液 B、Y单质在空气中燃烧的产物是 C、X和氢元素形成离子化合物 D、和互为同素异形体5. 下列关于不同价态含硫物质的转化实验,合理的是 A、图I:0价→+2价 B、图II:0价→+6价 C、图III:+4价→+6价 D、图IV:+6价→+4价6. 下列关于如图所示实验的说法中正确的是( )
A、图I:0价→+2价 B、图II:0价→+6价 C、图III:+4价→+6价 D、图IV:+6价→+4价6. 下列关于如图所示实验的说法中正确的是( ) A、若甲中烧瓶内是氨,要产生喷泉,则烧杯中的液体一定是水 B、若乙中烧瓶内是二氧化碳,烧杯中是碱溶液,用热毛巾焐热烧瓶片刻即可产生喷泉 C、若向丙装置中通入的气体X为HCl,则烧瓶内可产生白雾 D、若向丙装置中通入的气体X为 , 则烧瓶内一定无喷泉产生7. 碳纳米管是继足球烯()以后发现的又一种碳单质。下列有关碳纳米管与足球烯()的说法错误的是( )A、它们的物理性质有较大差异 B、在常温下它们的化学性质都稳定 C、它们是不同的碳单质 D、它们分别完全燃烧后生成物不同8. 下列计算结果正确且合理的是( )A、浓盐酸与足量完全反应产生(标准状况下) B、反应中氧化产物与还原产物的物质的量之比为1:2 C、将和等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的 D、标准状况下,用一充满气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内溶液的物质的量的浓度为9. .海盐经溶解、过滤后仍含有可溶性杂质 , 为了得到纯净的NaCl,下列试剂(均过量)的滴加顺序及操作顺序不合理的是( )A、溶液→NaOH溶液→溶液→过滤→稀盐酸→蒸发结晶 B、溶液→溶液→过滤→稀盐酸→蒸发结晶 C、溶液→NaOH溶液→溶液→过滤→稀盐酸→蒸发结晶 D、溶液→溶液→NaOH溶液→过滤→稀盐酸→蒸发结晶10. 将硫黄在氧气中燃烧生成气体A,把气体A溶于水得溶液B,向B中滴加溴水,溴水褪色而B变为C;在C中加入产生气体D,若将D通入B溶液,可得沉淀E;A、B、C、D、E中均含有硫元素。在下列各组中按A、B、C、D、E排列的是( )A、 B、 C、 D、11. 下列气体中,既可用浓硫酸干燥,又可用NaOH固体干燥的是( )
A、若甲中烧瓶内是氨,要产生喷泉,则烧杯中的液体一定是水 B、若乙中烧瓶内是二氧化碳,烧杯中是碱溶液,用热毛巾焐热烧瓶片刻即可产生喷泉 C、若向丙装置中通入的气体X为HCl,则烧瓶内可产生白雾 D、若向丙装置中通入的气体X为 , 则烧瓶内一定无喷泉产生7. 碳纳米管是继足球烯()以后发现的又一种碳单质。下列有关碳纳米管与足球烯()的说法错误的是( )A、它们的物理性质有较大差异 B、在常温下它们的化学性质都稳定 C、它们是不同的碳单质 D、它们分别完全燃烧后生成物不同8. 下列计算结果正确且合理的是( )A、浓盐酸与足量完全反应产生(标准状况下) B、反应中氧化产物与还原产物的物质的量之比为1:2 C、将和等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的 D、标准状况下,用一充满气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内溶液的物质的量的浓度为9. .海盐经溶解、过滤后仍含有可溶性杂质 , 为了得到纯净的NaCl,下列试剂(均过量)的滴加顺序及操作顺序不合理的是( )A、溶液→NaOH溶液→溶液→过滤→稀盐酸→蒸发结晶 B、溶液→溶液→过滤→稀盐酸→蒸发结晶 C、溶液→NaOH溶液→溶液→过滤→稀盐酸→蒸发结晶 D、溶液→溶液→NaOH溶液→过滤→稀盐酸→蒸发结晶10. 将硫黄在氧气中燃烧生成气体A,把气体A溶于水得溶液B,向B中滴加溴水,溴水褪色而B变为C;在C中加入产生气体D,若将D通入B溶液,可得沉淀E;A、B、C、D、E中均含有硫元素。在下列各组中按A、B、C、D、E排列的是( )A、 B、 C、 D、11. 下列气体中,既可用浓硫酸干燥,又可用NaOH固体干燥的是( )
A、 B、 C、 D、12. 卤族元素单质及其化合物应用广泛。具有与卤素单质相似的化学性质。在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的反应生成硫酰氟()。与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37。通入酸性溶液中可制得黄绿色气体 , 该气体常用作自来水消毒剂。工业用制备的热化学方程式为。下列物质性质与用途具有对应关系的是( )A、铜单质化学性质不活泼,可用于制作储存的容器 B、呈黄绿色,可用于自来水消毒 C、具有还原性,可用于与反应制 D、浓硫酸具有强氧化性,可用于与反应制HF13. X是中学化学常见的单质,Y、Z为化合物。它们有如图所示的转化关系(部分产物及反应条件省略)。下列判断正确的是( )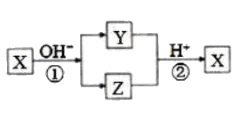 A、X可能是金属,也可能是非金属 B、X、Y、Z含有一种相同的元素 C、Y、Z的水溶液一定都呈碱性 D、反应①②不一定都是氧化还原反应
A、X可能是金属,也可能是非金属 B、X、Y、Z含有一种相同的元素 C、Y、Z的水溶液一定都呈碱性 D、反应①②不一定都是氧化还原反应二、非选择题:本题共4小题,共61分。
-
14. 某课外活动小组为了验证“干燥的CO2不能与Na2O2反应”和“CO2在有水存在时才能与Na2O2反应,且生成氧气”,设计了如下实验装置:

请回答下列问题:
(1)、试剂X是(填名称),其作用是。(2)、打开K1 , 关闭K2 , 打开分液漏斗活塞加入稀硫酸,产生气泡,1分钟后再点燃酒精灯加热铜丝。此步操作目的是 , 实验观察到铜丝未变化,则得出结论。(3)、打开K2 , 关闭K1 , 出现现象,可证明有水时CO2与Na2O2反应产生了O2。(4)、设计实验证明干燥管中的Na2O2转化为碳酸盐。(5)、写出CO2与Na2O2反应的化学方程式。15. 某小组为了探究硫酸的性质,设计如下实验:序号
操作
现象
①
常温下,在铁片中加入过量的浓硫酸
没有明显现象
②
常温下,在铜片上加入过量的浓硫酸
没有明显现象
③
在铜和过量30%的混合液中加入溶液
没有明显现象
④
在铜和过量30%的混合液中加入稀硫酸
溶液变蓝色,并产生气泡
回答下列问题:
(1)、实验①没有明显现象的原因是;改变一个条件,为使实验①中的反应持续发生,改变条件是。(2)、为了引发实验②中的反应,宜采取的措施是 , 实验后,观察产物水溶液的颜色,其操作方法是。(3)、实验④产生的气体是(填化学式),比较实验③和④可知,从氧化还原角度分析,的作用是;写出该反应的离子方程式:。(4)、向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12gM完全分解为10gCuO。M的化学式为;M能与稀硫酸酸化的KI溶液反应生成白色沉淀CuI(碘化亚铜),在滤液中加入淀粉溶液,溶液变蓝色。写出M和稀硫酸酸化的KI溶液反应的离子方程式:。16. 近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。实验目的:通过实验证明煤中含有碳元素和硫元素。
查阅资料:
(1)、“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:=+ (2)、根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
(2)、根据上述资料,甲同学和丙同学分别设计实验方案进行探究。实验探究:甲同学:甲同学进行了如图所示A、B两步实验:

“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
乙同学认为甲的方案不合理,其理由是:
(3)、实验探究:丙同学:丙同学进行了如图所示实验(部分装置在图中略去):
图C装置的作用是。
(4)、证明煤中含有碳元素和硫元素的现象是:。(5)、装置C中的高锰酸钾溶液也可以替换为____。A、足量I2的淀粉溶液 B、足量饱和NaHCO3溶液 C、足量溶液 D、足量溴水17. 氮化硅(Si,Na)可由石英与焦炭在高温的氮气流中通过以下反应制备:(1)、请写出氮化硅中氮元素的化合价,以及以上反应中的氧化剂和还原剂。
(2)、若该反应生成11.2L一氧化碳(标准状况),则生成氮化硅的质量是多少?