2024年中考化学三轮冲刺专项训练--计算题
试卷更新日期:2024-05-21 类型:三轮冲刺
一、选择题
-
1. 某品牌酒的酿造过程中发生了如下反应。下列说正确的是
 A、酒化酶在反应前后质量和性质都不发生改变 B、葡萄糖(C6H12O6)中C、H、O三种元素的质量比为1:2:1 C、酒精(C2H5OH)中含有2个碳原子、6个氢原子和1个氧原子 D、葡萄糖(C6H12O6)和酒精(C2H5OH)中,C元素的质量分数不相等2. 艾草含有丰富的黄酮素(C15H10O2),具有较高的药用价值。下列关于黄酮素的说法中错误的是A、黄酮素中含有氧分子 B、黄酮素由碳、氢、氧三种元素组成 C、黄酮素完全燃烧生成CO2和H2O D、黄酮素中氢元素的质量分数最小3. 碱式碳酸【Cu2(OH)2CO3】加热分解生成氧化铜、水和二氧化碳。充分加热24.8g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3:4,则该反应生成水的质量为( )A、1.8g B、2.4g C、3.6g D、5.4g4. 下图为识别考生信息的条形码(样码)。条形码有黏性,其黏性主要来源于胶黏剂丙烯酸(),下列有关丙烯酸的说法合理的是( )
A、酒化酶在反应前后质量和性质都不发生改变 B、葡萄糖(C6H12O6)中C、H、O三种元素的质量比为1:2:1 C、酒精(C2H5OH)中含有2个碳原子、6个氢原子和1个氧原子 D、葡萄糖(C6H12O6)和酒精(C2H5OH)中,C元素的质量分数不相等2. 艾草含有丰富的黄酮素(C15H10O2),具有较高的药用价值。下列关于黄酮素的说法中错误的是A、黄酮素中含有氧分子 B、黄酮素由碳、氢、氧三种元素组成 C、黄酮素完全燃烧生成CO2和H2O D、黄酮素中氢元素的质量分数最小3. 碱式碳酸【Cu2(OH)2CO3】加热分解生成氧化铜、水和二氧化碳。充分加热24.8g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3:4,则该反应生成水的质量为( )A、1.8g B、2.4g C、3.6g D、5.4g4. 下图为识别考生信息的条形码(样码)。条形码有黏性,其黏性主要来源于胶黏剂丙烯酸(),下列有关丙烯酸的说法合理的是( ) A、丙烯酸中含有氧分子 B、丙烯酸中元素质量分数最大的是碳元素 C、丙烯酸中碳元素与氧元素的质量比为3:2 D、丙烯酸由3个碳原子、4个氢原子和2个氧原子构成5. H2还原Fe2O3的过程大致分为三个阶段。在持续加热下,向9.6gFe2O3中不断通入H2 , 实验测得固体残留率( )随温度的变化曲线如图所示。下列叙述正确的是( )
A、丙烯酸中含有氧分子 B、丙烯酸中元素质量分数最大的是碳元素 C、丙烯酸中碳元素与氧元素的质量比为3:2 D、丙烯酸由3个碳原子、4个氢原子和2个氧原子构成5. H2还原Fe2O3的过程大致分为三个阶段。在持续加热下,向9.6gFe2O3中不断通入H2 , 实验测得固体残留率( )随温度的变化曲线如图所示。下列叙述正确的是( )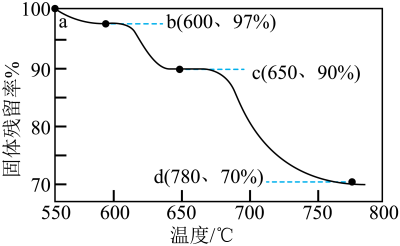 A、随着反应进行,黑色固体透渐变为红棕色 B、ab段反应的化学方程式为 C、从a到d点,固体减少的质量等于生成的水的质量 D、d点对应固体为Fe,其质量为6.32g6. 深圳盐田的盐文化历史悠远。盐池中通常含有NaCl和Na2CO3 , 两种物质的溶解度曲线如图所示,下列说法正确的是
A、随着反应进行,黑色固体透渐变为红棕色 B、ab段反应的化学方程式为 C、从a到d点,固体减少的质量等于生成的水的质量 D、d点对应固体为Fe,其质量为6.32g6. 深圳盐田的盐文化历史悠远。盐池中通常含有NaCl和Na2CO3 , 两种物质的溶解度曲线如图所示,下列说法正确的是 A、Na2CO3的溶解度等于NaCl B、海水晒盐主要是利用蒸发结晶的方法 C、t1℃的Na2CO3饱和溶液降低温度后可变成饱和溶液 D、t2℃,可以配制溶质质量分数为36.5%的NaCl溶液7. 下列图像不能正确反映其对应关系的是( )A、
A、Na2CO3的溶解度等于NaCl B、海水晒盐主要是利用蒸发结晶的方法 C、t1℃的Na2CO3饱和溶液降低温度后可变成饱和溶液 D、t2℃,可以配制溶质质量分数为36.5%的NaCl溶液7. 下列图像不能正确反映其对应关系的是( )A、 向盛有一定量MnO2的烧杯中不断加入双氧水
B、
向盛有一定量MnO2的烧杯中不断加入双氧水
B、 一定量的镁在足量氧气中燃烧
C、
一定量的镁在足量氧气中燃烧
C、 某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
D、
某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
D、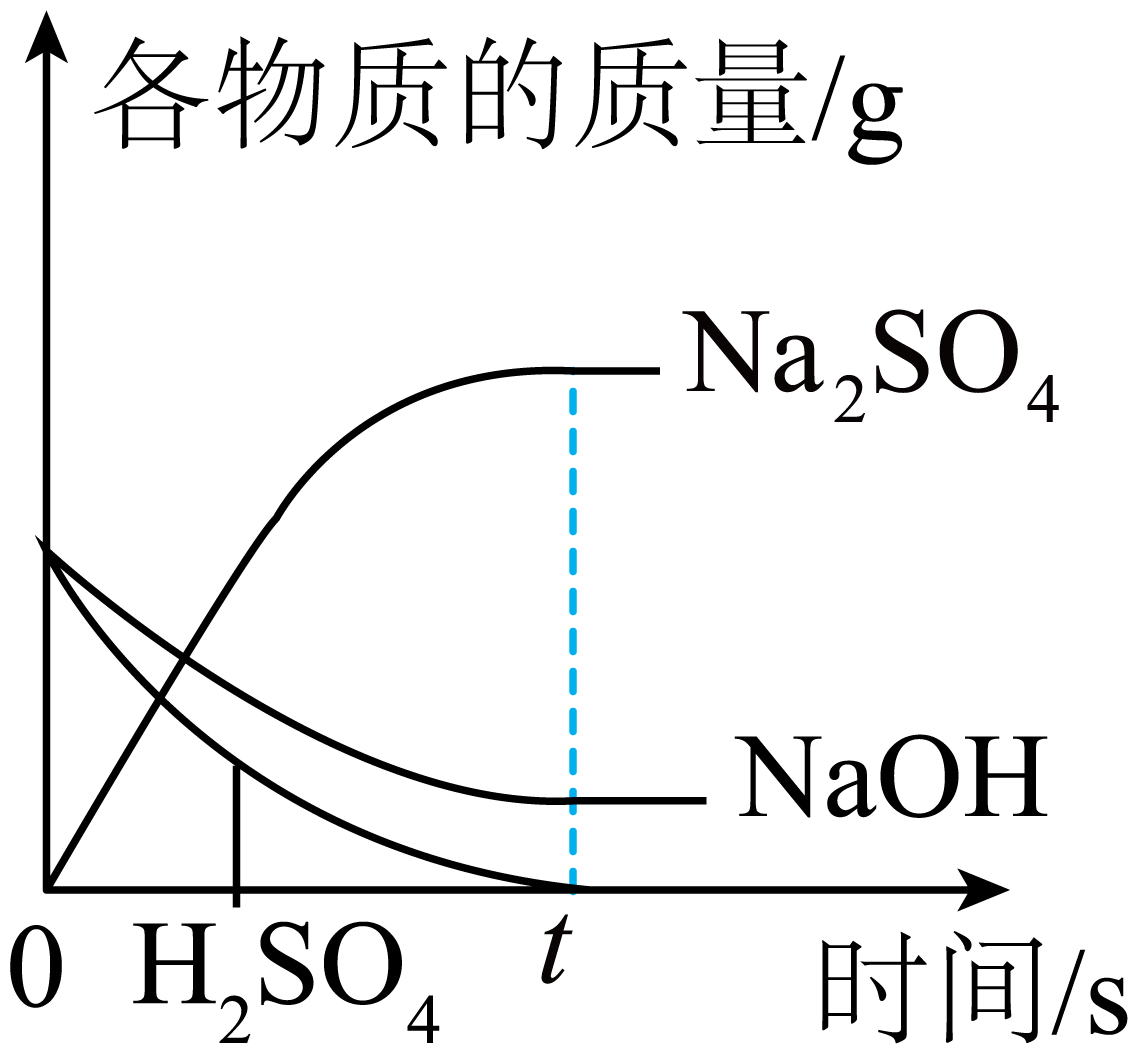 100g溶质质量分数为10%的稀硫酸与100g溶质质量分数为10%的氢氧化钠溶液混合
8. 图甲所示为t1℃时相同质量的A、B两种物质分别溶解在100g的水中,再将两种溶液分别升温至t2℃、t3℃时溶液的变化情况;图乙所示为两种物质的溶解度曲线。下列说法错误的是( )
100g溶质质量分数为10%的稀硫酸与100g溶质质量分数为10%的氢氧化钠溶液混合
8. 图甲所示为t1℃时相同质量的A、B两种物质分别溶解在100g的水中,再将两种溶液分别升温至t2℃、t3℃时溶液的变化情况;图乙所示为两种物质的溶解度曲线。下列说法错误的是( ) A、M表示物质A的溶解度曲线 B、t2℃时,溶液③和溶液④中溶质质量相等 C、t1℃时,加入物质A、B的质量均是20g D、t3℃时,向溶液⑤加入60g物质A可全部溶解9. 水和乙醇(酒精)都是工业上重要的溶剂。NaOH在水和乙醇中的溶解度曲线如图所示,下列说法正确的是( )
A、M表示物质A的溶解度曲线 B、t2℃时,溶液③和溶液④中溶质质量相等 C、t1℃时,加入物质A、B的质量均是20g D、t3℃时,向溶液⑤加入60g物质A可全部溶解9. 水和乙醇(酒精)都是工业上重要的溶剂。NaOH在水和乙醇中的溶解度曲线如图所示,下列说法正确的是( ) A、NaOH在不同溶剂中的溶解能力差别不大 B、20℃时100g水中至少能溶解109gNaOH C、0℃时NaOH在乙醇中几乎不溶 D、NaOH在水和乙醇中的溶解能力都随温度升高而减小10. 图1为和两种固体的溶解度曲线,根据图1、图2分析,下列说法正确的是( )
A、NaOH在不同溶剂中的溶解能力差别不大 B、20℃时100g水中至少能溶解109gNaOH C、0℃时NaOH在乙醇中几乎不溶 D、NaOH在水和乙醇中的溶解能力都随温度升高而减小10. 图1为和两种固体的溶解度曲线,根据图1、图2分析,下列说法正确的是( ) A、点处和两种溶液中溶质的质量相等 B、点处溶液中溶质的质量分数为 C、时,分别将和的饱和溶液恒温蒸发等质量的水,析出固体的质量多 D、图2中“某一步操作”前后的溶液状态变化过程可以在图1表示为点点
A、点处和两种溶液中溶质的质量相等 B、点处溶液中溶质的质量分数为 C、时,分别将和的饱和溶液恒温蒸发等质量的水,析出固体的质量多 D、图2中“某一步操作”前后的溶液状态变化过程可以在图1表示为点点二、计算题
-
11. 化学兴趣小组的同学为确定某铁合金样品是生铁还是钢,他们取22.6g铁合金样品盛放到锥形瓶中,将100g稀硫酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
次数
第1次
第2次
第3次
第4次
第5次
加入稀硫酸的质量(g)
20
20
20
20
20
瓶中物质总质量(g)
42.4
m
82.0
101.8
121.8
(假设铁合金样品中只含有铁、碳两种元素)
请回答下列问题:
(1)、硫酸(H2SO4)由元素组成。(2)、表格中的m的值为。(3)、通过计算判断该铁合金样品是生铁还是钢。(请写出计算过程,结果精确到0.01%)12. 实验室有一瓶未知浓度的盐酸。为测定该盐酸中溶质的质量分数,化学兴趣小组向25.0g盐酸样品中逐滴滴入质量分数为20.0%的氢氧化钠溶液,所得溶液温度与加入氢氧化钠溶液质量的变化关系如图所示。
回答下列问题:
(1)、氢氧化钠与盐酸反应(填“放出”或“吸收”)热量。(2)、计算该盐酸中溶质的质量分数(精确到0.1%)。13. 向10.0gNa2CO3和NaCl固体混合物加入50.0g水,充分溶解后,向溶液中逐渐加入50.0g的CaCl2溶液,实验过程中产生沉淀的质量与加入CaCl2溶液质量关系如图所示。 (1)、充分反应后,生成沉淀的质量是;(2)、恰好完全反应时,所得溶液中溶质的质量分数是多少?(写出计算过程,结果保留0.01%)14. ZnO用于制作油漆、药物等。将一定量的ZnO加入到100gNaOH溶液中,恰好完全反应,反应后溶液质量为108.1g。计算:(1)、ZnO的质量为g。(2)、NaOH溶液中溶质的质量分数是多少?(化学方程式:)15. 某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加 7稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g 烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)、充分反应后,生成沉淀的质量是;(2)、恰好完全反应时,所得溶液中溶质的质量分数是多少?(写出计算过程,结果保留0.01%)14. ZnO用于制作油漆、药物等。将一定量的ZnO加入到100gNaOH溶液中,恰好完全反应,反应后溶液质量为108.1g。计算:(1)、ZnO的质量为g。(2)、NaOH溶液中溶质的质量分数是多少?(化学方程式:)15. 某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加 7稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g 烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。 (1)、当碳酸钠溶液质量加到g时,溶液中盐酸恰好完全反应。(2)、计算烧杯中10g溶液中氯化钡的质量分数。(写出计算过程,计算结果精确至0.1%)16. 为测定某硫酸溶液的溶质质量分数,实验小组设计了以下方案:在烧杯中加入该硫酸溶液100g,然后向烧杯中逐滴加入氢氧化钡溶液,滴加的氢氧化钡溶液质量与生成沉淀的质量关系如图所示。请你帮其解决下列问题:
(1)、当碳酸钠溶液质量加到g时,溶液中盐酸恰好完全反应。(2)、计算烧杯中10g溶液中氯化钡的质量分数。(写出计算过程,计算结果精确至0.1%)16. 为测定某硫酸溶液的溶质质量分数,实验小组设计了以下方案:在烧杯中加入该硫酸溶液100g,然后向烧杯中逐滴加入氢氧化钡溶液,滴加的氢氧化钡溶液质量与生成沉淀的质量关系如图所示。请你帮其解决下列问题: (1)、恰好完全反应时,生成沉淀的质量为g。(2)、求该硫酸溶液中溶质的质量分数(写出计算过程)。17. 实验室有一包铁粉和铜粉的混合物,现取该混合物10g于烧杯中,进行如下实验。请根据图中实验过程及数据进行计算。
(1)、恰好完全反应时,生成沉淀的质量为g。(2)、求该硫酸溶液中溶质的质量分数(写出计算过程)。17. 实验室有一包铁粉和铜粉的混合物,现取该混合物10g于烧杯中,进行如下实验。请根据图中实验过程及数据进行计算。 (1)、混合物中铁粉的质量为。(2)、计算稀硫酸中溶质的质量分数。(写出计算过程)18. 为测定某溶液的溶质质量分数,化学小组的同学取溶液100g,向其中滴加一定浓度的溶液,随着溶液的加入,生成沉淀的质量如表:
(1)、混合物中铁粉的质量为。(2)、计算稀硫酸中溶质的质量分数。(写出计算过程)18. 为测定某溶液的溶质质量分数,化学小组的同学取溶液100g,向其中滴加一定浓度的溶液,随着溶液的加入,生成沉淀的质量如表:第Ⅰ组
第Ⅱ组
第Ⅲ组
第Ⅳ组
第Ⅴ组
第Ⅵ组
氢氧化钠溶液的质量/g
16
32
48
64
80
96
生成沉淀的质量/g
1.96
n
5.88
7.84
9.80
9.80
(1)、第Ⅱ组数据n为g;(2)、求该溶液中溶质的质量分数。(写出计算过程)19. 工业生产的氯化钙溶液中常混有盐酸,为测定该溶液中氯化钙的质量分数,某兴趣小组的同学做了如下实验:如图1所示,常温下取该溶液15g于烧杯中,用碱式滴定管逐滴滴入溶质质量分数为21.2%的碳酸钠溶液至过量(生成的CO2全部逸出),溶液的pH随碳酸钠溶液滴入质量的变化关系如图2所示。(已知:NaCl和氯化钙的水溶液均为中性,Na2CO3水溶液为碱性)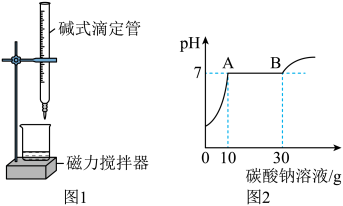 (1)、图2中B点对应的溶液含有的溶质是(填化学式)。(2)、请计算该溶液中氯化钙的质量分数(写出计算过程)。20. 我国承诺:2030年“碳达峰”,2060年“碳中和”,即通过各种方式抵消排放二氧化碳的量,重新实现碳平衡。(1)、碳封存:二氧化碳可被压缩成液态封存在地质结构中,从微观角度解释二氧化碳被压缩成液态后,分子间间隔变(填“大”或“小”)。(2)、碳转化:一定条件下,可将二氧化碳和氢气在催化剂表面转化为清洁的液体燃料甲醇(化学式为CH3OH)和水,消耗440t的二氧化碳可转化成t甲醇。(3)、碳捕捉:科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环的过程如下图所示。
(1)、图2中B点对应的溶液含有的溶质是(填化学式)。(2)、请计算该溶液中氯化钙的质量分数(写出计算过程)。20. 我国承诺:2030年“碳达峰”,2060年“碳中和”,即通过各种方式抵消排放二氧化碳的量,重新实现碳平衡。(1)、碳封存:二氧化碳可被压缩成液态封存在地质结构中,从微观角度解释二氧化碳被压缩成液态后,分子间间隔变(填“大”或“小”)。(2)、碳转化:一定条件下,可将二氧化碳和氢气在催化剂表面转化为清洁的液体燃料甲醇(化学式为CH3OH)和水,消耗440t的二氧化碳可转化成t甲醇。(3)、碳捕捉:科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环的过程如下图所示。
①为确定步骤2中碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量(填溶液名称),若观察到试管内有气泡产生,则分解不完全。
②上述设想的优点有(填序号)。
a.原料易得且可循环使用 b.充分利用太阳能 c.可全地域全天候使用