专题十一 混合物阶段反应--2023-2024学年浙教版科学中考专题突破
试卷更新日期:2024-05-21 类型:三轮冲刺
一、单选题
-
1. 向MgSO4溶液中逐滴滴入溶质质量分数为20%的NaOH溶液,溶液总质量与滴入NaOH溶液质量关系曲线如图所示。下列说法正确的是( )
 A、a点时溶液中的溶质为NaOH、Na2SO4 B、b点时溶液的pH=7 C、原溶液中MgSO4的质量分数为7.5% D、a点时锥形瓶内所得溶液的溶质质量分数约为12.4%2. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )
A、a点时溶液中的溶质为NaOH、Na2SO4 B、b点时溶液的pH=7 C、原溶液中MgSO4的质量分数为7.5% D、a点时锥形瓶内所得溶液的溶质质量分数约为12.4%2. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )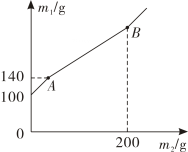 A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g3. 室温下,向盛有硫酸和硫酸铜混合溶液的烧杯滴入Ba(OH)2溶液,生成沉淀的质量与加入的Ba(OH)2溶液中溶质质量的关系如图所示。下列有关说法不正确的是( )
A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g3. 室温下,向盛有硫酸和硫酸铜混合溶液的烧杯滴入Ba(OH)2溶液,生成沉淀的质量与加入的Ba(OH)2溶液中溶质质量的关系如图所示。下列有关说法不正确的是( ) A、a→b段溶液的质量在不断减小 B、n点溶液中的溶质为硫酸铜 C、b点溶液的pH小于d点 D、c点对应纵坐标的数值为5.644. 室温下,向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH)2 溶液,生成沉淀的质量与加入的Ba(OH)2溶液中溶质质量的关系如图所示。下列有关说法不正确的是( )
A、a→b段溶液的质量在不断减小 B、n点溶液中的溶质为硫酸铜 C、b点溶液的pH小于d点 D、c点对应纵坐标的数值为5.644. 室温下,向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH)2 溶液,生成沉淀的质量与加入的Ba(OH)2溶液中溶质质量的关系如图所示。下列有关说法不正确的是( ) A、a→b段溶液的质量在不断减小 B、n点溶液中的溶质为硫酸铜 C、b点溶液的pH小于d点 D、c点对应纵坐标的数值为5.645. 向100g稀硫酸中先加入20g的CuO粉末充分反应后再加入20g的铁粉,所得溶液质量与加入粉末总质量之间的关系如图所示,下列分析中不正确的是( )
A、a→b段溶液的质量在不断减小 B、n点溶液中的溶质为硫酸铜 C、b点溶液的pH小于d点 D、c点对应纵坐标的数值为5.645. 向100g稀硫酸中先加入20g的CuO粉末充分反应后再加入20g的铁粉,所得溶液质量与加入粉末总质量之间的关系如图所示,下列分析中不正确的是( ) A、原稀硫酸的溶质质量分数为19.6% B、m值为16 C、d点对应的溶液质量为111.2g D、当加入固体n克时析出的固体总质量为16.8克6. 往硫酸和硫酸铜的混合溶液中,逐滴加入氢氧化钠溶液直至过量,根据实验绘制如图所示曲线,下列说法正确的是( )
A、原稀硫酸的溶质质量分数为19.6% B、m值为16 C、d点对应的溶液质量为111.2g D、当加入固体n克时析出的固体总质量为16.8克6. 往硫酸和硫酸铜的混合溶液中,逐滴加入氢氧化钠溶液直至过量,根据实验绘制如图所示曲线,下列说法正确的是( ) A、a至b段有蓝色沉淀产生 B、d点溶质种类为三种 C、c至d段,溶液pH不断减小 D、c点所含溶质种类最少7. 向盛有CuSO4和H2SO4混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量、溶质质量和溶剂质量随NaOH溶液质量变化关系如右图。下列说法错误的是( )
A、a至b段有蓝色沉淀产生 B、d点溶质种类为三种 C、c至d段,溶液pH不断减小 D、c点所含溶质种类最少7. 向盛有CuSO4和H2SO4混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量、溶质质量和溶剂质量随NaOH溶液质量变化关系如右图。下列说法错误的是( ) A、乙代表溶质质量 B、Q点溶液中溶质为Na2SO4 C、O→P过程反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O D、原溶液中CuSO4和H2SO4质量相等8. 一定温度下,向agFeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图所示。下列叙述正确的是( )
A、乙代表溶质质量 B、Q点溶液中溶质为Na2SO4 C、O→P过程反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O D、原溶液中CuSO4和H2SO4质量相等8. 一定温度下,向agFeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图所示。下列叙述正确的是( ) A、MP段发生的反应为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓ B、m-n=c-b C、P点对应的溶液中溶质的种类有三种 D、生成Fe(OH)3的质量为(n﹣c+a)g9. 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的 Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )
A、MP段发生的反应为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓ B、m-n=c-b C、P点对应的溶液中溶质的种类有三种 D、生成Fe(OH)3的质量为(n﹣c+a)g9. 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的 Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( ) A、图中0a段表示生成沉淀的过程 B、b点溶液中溶质有2种 C、c点溶液的pH=7 D、x值为106.010. 在5.6g铁粉中,先逐滴加入一定量的硝酸铜溶液,充分反应后再逐滴加入硝酸银溶液,固体质量与所加溶液总质量的关系如图所示。下列有关说法正确的是( )
A、图中0a段表示生成沉淀的过程 B、b点溶液中溶质有2种 C、c点溶液的pH=7 D、x值为106.010. 在5.6g铁粉中,先逐滴加入一定量的硝酸铜溶液,充分反应后再逐滴加入硝酸银溶液,固体质量与所加溶液总质量的关系如图所示。下列有关说法正确的是( ) A、b点时,生成铜的质量等于m1g B、be段反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2 C、e点时,溶液中含有的溶质有2种 D、m3的数值为21.6
A、b点时,生成铜的质量等于m1g B、be段反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2 C、e点时,溶液中含有的溶质有2种 D、m3的数值为21.6二、填空题
-
11. 室温时,向滴加了无色酚酞的溶液的烧杯中逐滴加入稀硫酸,烧杯内溶液中的溶质质变化如图所示:
 (1)、c点溶液中的溶质为。(2)、ob段实验的现象是。12. 为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取50g该混合酸,逐滴滴加某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示。
(1)、c点溶液中的溶质为。(2)、ob段实验的现象是。12. 为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取50g该混合酸,逐滴滴加某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示。 (1)、当加入的氢氧化钡溶液为g时,混合酸恰好被中和;(2)、50g该混合酸中盐酸的溶质质量是g(精确到0.01)。13. 向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
(1)、当加入的氢氧化钡溶液为g时,混合酸恰好被中和;(2)、50g该混合酸中盐酸的溶质质量是g(精确到0.01)。13. 向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。 (1)、当加入NaOH溶液质量为ag时,溶液中含有的溶质为;(2)、原混合溶液中,溶质H2SO4的质量为 g。14. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na2CO3溶液质量的变化情况。图中AB段对应的实验现象是 , 在C点时溶液中的溶质是。
(1)、当加入NaOH溶液质量为ag时,溶液中含有的溶质为;(2)、原混合溶液中,溶质H2SO4的质量为 g。14. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na2CO3溶液质量的变化情况。图中AB段对应的实验现象是 , 在C点时溶液中的溶质是。 15. 向一定质量的CaCl₂和HCl的混合溶液中逐滴加入 Na₂CO₃溶液,并振荡。如图表示反应过程中 溶 液 质量 随加入Na₂CO₃溶液质量的变化情况。AB段对应的实验现象是 , 在C点时溶液中的溶质是。
15. 向一定质量的CaCl₂和HCl的混合溶液中逐滴加入 Na₂CO₃溶液,并振荡。如图表示反应过程中 溶 液 质量 随加入Na₂CO₃溶液质量的变化情况。AB段对应的实验现象是 , 在C点时溶液中的溶质是。 16. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,根据图回答下列问题:
16. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,根据图回答下列问题: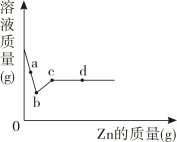
a点溶液中的溶质有。取d点的固体,加入稀盐酸,可观察到的实验现象是。
17. 实验室有一由盐酸和氯化钡组成的混合溶液,科学小组为了测定该混合溶液中各成分的含量,向其中逐滴滴入一定溶质质量分数的碳酸钠溶液直至过量,溶液总质量随滴入碳酸钠溶液的质量的变化关系如图所示。 (1)、D点对应的溶液中,含有的溶质为(2)、BC段过程中,溶液的 pH 如何变化?(3)、与盐酸完全反应产生的CO2的质量是克。18. 小敏同学在实验室中制取CO2气体,为对废液进行后续探究,他向一定质量的含CaCl2和HCl的溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液。实验过程中加入Na2CO3溶液的质量与溶液的pH变化关系如图所示,那么hk段出现的实验现象为 , 在k点的溶液中的溶质为。
(1)、D点对应的溶液中,含有的溶质为(2)、BC段过程中,溶液的 pH 如何变化?(3)、与盐酸完全反应产生的CO2的质量是克。18. 小敏同学在实验室中制取CO2气体,为对废液进行后续探究,他向一定质量的含CaCl2和HCl的溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液。实验过程中加入Na2CO3溶液的质量与溶液的pH变化关系如图所示,那么hk段出现的实验现象为 , 在k点的溶液中的溶质为。
三、实验探究题
-
19. 实验室用金属镁与100g盐酸反应探究酸的性质。小宁取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。
 (1)、0.58g沉淀的成分为。(2)、a点时,与NaOH反应的物质化学式是 。(3)、若在b点溶液中滴加 AgNO3 溶液,出现白色沉淀,(填“能”或“不能”)证明HCl有剩余。(4)、计算100g稀盐酸的溶质质量分数。20. 小保向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。则
(1)、0.58g沉淀的成分为。(2)、a点时,与NaOH反应的物质化学式是 。(3)、若在b点溶液中滴加 AgNO3 溶液,出现白色沉淀,(填“能”或“不能”)证明HCl有剩余。(4)、计算100g稀盐酸的溶质质量分数。20. 小保向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。则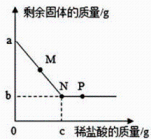
①混合物中铜的质量为
②N、P点时,溶液的pH:NP(选填<、>、=)
③M点时,溶液中的溶质有(填化学式)。
21. 某实验小组同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中加入稀盐酸,一会儿后,发现忘记了滴加指示剂。于是,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行了探究。提出问题:该烧杯内溶液中的溶质是什么?猜想假设:猜想一:可能是CaCl2和Ca(OH)2
猜想二:可能是CaCl2和HCl;猜想三:可能是(填化学式);查阅资料:氯化钙溶液呈中性。
进行实验:实验步骤1:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,实验现象。结论:猜想一不正确。
实验步骤2:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量。实验过程中测得溶液的pH随滴入碳酸钠溶液质量的变化关系如图所示,则实验中出现的现象是 。结论:猜想二正确。
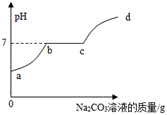
反思拓展:证明酸碱发生化学反应时常选用无色酚酞试液而不选紫色石蕊试液,其原因是 。
22. 某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
(提出问题)该烧杯内溶液中的溶质是什么?
(猜 想)猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:。
(查阅资料)氯化钙溶液呈中性。
(进行实验)
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:。结论:猜想一不正确。
实验步骤:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象:。结论:猜想二不正确,猜想三正确。
根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?(填序号)
A.pH试纸 B.铜 C.紫色石蕊溶液 D.硝酸银溶液
四、解答题
-
23. 烧杯中盛有MgCl2和HCl的混合溶液100.0g,向其中滴加溶质质量分数为10.0%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示.
 (1)、图中ab段所对应的反应的化学方程式;(2)、图中bc段溶液增加的质量为克。(3)、图中d点对应的溶液中的离子有哪些?.(4)、求图中c点对应溶液的溶质质量分数?24. 向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中产生沉淀或气体的质量与加入溶液的质量关系如图所示,实验过程中产生的气体全部逸出。请回答以下问题:
(1)、图中ab段所对应的反应的化学方程式;(2)、图中bc段溶液增加的质量为克。(3)、图中d点对应的溶液中的离子有哪些?.(4)、求图中c点对应溶液的溶质质量分数?24. 向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中产生沉淀或气体的质量与加入溶液的质量关系如图所示,实验过程中产生的气体全部逸出。请回答以下问题: (1)、实验过程所发生的反应的基本类型是;(2)、原混合物中硫酸钠的质量是多少克?(写出解答过程)(3)、d点对应的溶液中的溶质有。
(1)、实验过程所发生的反应的基本类型是;(2)、原混合物中硫酸钠的质量是多少克?(写出解答过程)(3)、d点对应的溶液中的溶质有。