专题十 金属及其活动性--2023-2024学年浙教版科学中考专题突破
试卷更新日期:2024-05-21 类型:三轮冲刺
一、选择题
-
1. 锰(Mn)是一种应用广泛的金属材料。小科将锰条放入稀盐酸中,发现锰条表面产生气泡,其反应化学方程式为:Mn+2HCl=MnCl2+H2↑。据此实验结果分析,下列说法不正确的是( )A、该反应属于置换反应 B、锰的金属活动性比银强 C、锰条能与硫酸铜溶液反应 D、利用锰条和硫酸锌溶液不能比较出锰与锌的金属活动性强弱2. 下列图像与实验设计对应正确的有( )
图像




设计实验
甲:向未经打磨的铝片中滴加适量稀盐酸
乙:向中滴加溶液
丙:分别向等质量的和中加入足量的稀盐酸
丁:足量红磷在密闭的集气瓶中燃烧
A、甲、乙 B、甲、丙 C、乙、丁 D、丙、丁3. 常温下,相同质量的镁和铁分别与足量的溶质质量分数相同的稀硫酸反应,以下图像中纵坐标表示生成氢气的质量,横坐标表示相关的量。其中图像表示正确的是( )A、 B、
B、 C、
C、 D、
D、 4. 将某金属M和金属镁的粉末状混合物ag加入一定质量的Cu(NO3)2溶液中,充分反应后过滤,得到滤液和滤渣。下列有关判断中错误的是( )A、若滤渣中含有Cu和Fe,则滤液可能为浅绿色溶液 B、滤渣的质量一定大于ag C、若向滤渣中加入稀盐酸没有气泡生成,滤渣中一定含有Cu,可能含有金属M D、若滤液中金属离子只含有Mg2+ , 则说明)的活动性比M强,金属活 动性可能为Mg>M>Cu5. 已知X、Y、Z三种金属,它们之间存在下列反应①X+H2SO4═XSO4+H2↑ ②Z+YSO4═ZSO4+Y ③Y、Z与H2SO4 不发生反应.请你选择它们的活动性顺序表示正确的是( )A、X>Y>Z B、Y>X>Z C、Z>X>Y D、X>Z>Y6. 在定量研究金属与酸的化学反应时,绘制出如图所示金属与氢气质量关系的图像。分析图像得到的以下结论中正确的是( )
4. 将某金属M和金属镁的粉末状混合物ag加入一定质量的Cu(NO3)2溶液中,充分反应后过滤,得到滤液和滤渣。下列有关判断中错误的是( )A、若滤渣中含有Cu和Fe,则滤液可能为浅绿色溶液 B、滤渣的质量一定大于ag C、若向滤渣中加入稀盐酸没有气泡生成,滤渣中一定含有Cu,可能含有金属M D、若滤液中金属离子只含有Mg2+ , 则说明)的活动性比M强,金属活 动性可能为Mg>M>Cu5. 已知X、Y、Z三种金属,它们之间存在下列反应①X+H2SO4═XSO4+H2↑ ②Z+YSO4═ZSO4+Y ③Y、Z与H2SO4 不发生反应.请你选择它们的活动性顺序表示正确的是( )A、X>Y>Z B、Y>X>Z C、Z>X>Y D、X>Z>Y6. 在定量研究金属与酸的化学反应时,绘制出如图所示金属与氢气质量关系的图像。分析图像得到的以下结论中正确的是( )
①Na、Mg、Zn三种金属都能置换出酸中的氢
②生成相同质量的氢气消耗金属的质量为Na>Mg=Zn
③生成相同质量的氢气消耗Na、Mg、Zn三种金属的质量比为23∶24∶65
④生成相同质量的氢气消耗Na、Mg、Zn三种金属的原子个数比为2∶1∶1
A、①② B、②③ C、③④ D、①④7. 向AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入一定量的Zn粉,充分反应后过滤,将滤渣洗涤、干燥、称量,发现滤渣的质量等于加入Zn粉的质量。下列分析正确的是( )A、滤液中的溶质至少有两种 B、取反应后的滤液滴加稀盐酸,一定无白色沉淀 C、取反应后的滤渣滴加稀盐酸,一定有气泡生成 D、反应后所得的溶液一定是无色的8. 将等质量的锌、铁、镁三种金属分别加入三杯质量和溶质质量分数均相同的稀盐酸中,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )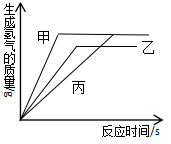 A、反应后金属镁和铁有剩余 B、反应后乙杯中的溶质可能只有一种 C、参加反应的锌和铁的质量比可能为8: 7 D、反应后,在甲杯中滴入硝酸银溶液有沉淀产生,说明盐酸可能有剩余9. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“---”表示相邻的两种物质能发生反应。若甲为铁, 乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种, 则下列判断错误的是( )
A、反应后金属镁和铁有剩余 B、反应后乙杯中的溶质可能只有一种 C、参加反应的锌和铁的质量比可能为8: 7 D、反应后,在甲杯中滴入硝酸银溶液有沉淀产生,说明盐酸可能有剩余9. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“---”表示相邻的两种物质能发生反应。若甲为铁, 乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种, 则下列判断错误的是( )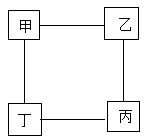 A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO410. 兴趣小组按如图流程进行实验(每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是( )
A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO410. 兴趣小组按如图流程进行实验(每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是( ) A、由实验可判断出铁、铜、锌的活动性顺序 B、两支试管混合后,固体总质量一定增加 C、滤渣中一定有Cu,一定没有Fe和Zn D、滤液中的溶质一定有FeCl2、ZnCl2和CuCl2
A、由实验可判断出铁、铜、锌的活动性顺序 B、两支试管混合后,固体总质量一定增加 C、滤渣中一定有Cu,一定没有Fe和Zn D、滤液中的溶质一定有FeCl2、ZnCl2和CuCl2二、填空题
-
11. 某工厂欲从含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
 (1)、操作Ⅰ的名称是;(2)、A物质的化学式是;(3)、加入适量H2SO4时发生化学反应的化学方程式是。12. 镍(Ni)是一中常见金属,在生产生活中发挥着重要的作用。(1)、具有“记忆”本领的钛镍合金属于(选填“纯净物”或“混合物”)﹔(2)、铁表面镀镍,使铁不易锈蚀,原因是隔绝了铁与接触;(3)、已知镍的金属活动性位于镁和铜之间,下列四种方案,能验证镁、镍、铜三种金属的活动性顺序方案有。(填写字母)。
(1)、操作Ⅰ的名称是;(2)、A物质的化学式是;(3)、加入适量H2SO4时发生化学反应的化学方程式是。12. 镍(Ni)是一中常见金属,在生产生活中发挥着重要的作用。(1)、具有“记忆”本领的钛镍合金属于(选填“纯净物”或“混合物”)﹔(2)、铁表面镀镍,使铁不易锈蚀,原因是隔绝了铁与接触;(3)、已知镍的金属活动性位于镁和铜之间,下列四种方案,能验证镁、镍、铜三种金属的活动性顺序方案有。(填写字母)。 13. “宏观——微观——符号”三重表征可用来表述物质及其变化。
13. “宏观——微观——符号”三重表征可用来表述物质及其变化。请结合图示回答:
 (1)、实验a中,金属R表面有固体物质析出,实验b中,锌表面有黑色固体物质析出。由此可知R、Zn、Ag的活动性由强到弱为。(2)、根据图c分析实验a中增加的离子是(填离子符号)。(3)、实验b反应过程中,Zn2+、R2+和SO42-三种离子个数比可能是 。A、1:1:1 B、1:1:2 C、1:2:3 D、1:3:514. 人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)、实验a中,金属R表面有固体物质析出,实验b中,锌表面有黑色固体物质析出。由此可知R、Zn、Ag的活动性由强到弱为。(2)、根据图c分析实验a中增加的离子是(填离子符号)。(3)、实验b反应过程中,Zn2+、R2+和SO42-三种离子个数比可能是 。A、1:1:1 B、1:1:2 C、1:2:3 D、1:3:514. 人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。 (1)、根据上图金属应用实例推断,金属具有的物理性质有(写出1条即可):;(2)、日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能。
(1)、根据上图金属应用实例推断,金属具有的物理性质有(写出1条即可):;(2)、日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能。合金
合金的主要性能
主要成分及纯金属的性能
焊锡
熔点183 ℃
锡:熔点232℃;铅:熔点327 ℃
硬铝
强度和硬度好
铝、铜、镁等。硬度小,质软
不锈钢
抗腐蚀性好
铁、铬、镍等。纯铁抗腐蚀性能不如不锈钢
由表中信息可以推断,与组成合金的纯金属相比,合金的优点一般有(填序号,可多选)。
①强度更低
②硬度更高
③熔点更高
④抗腐蚀性更好
15. 在实验课中,各小组做了如下实验:

实验后,同学们按老师要求将废液都倒在指定的大烧杯中。小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁……,应该可以从中提取出铁和铜。经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同。则:固体C是 , 操作③的名称是 , 实验中所加的过量金属粉末是 。
16. 金属冶炼是把金属化合物转变成金属单质,如炼铜的方法有:(1)、湿法炼铜:Fe+CuSO4=Cu+FeSO4 , 这是利用铁的活动性比铜(2)、干法炼铜:CO+CuO Cu+CO2 , 这是利用CO的性。三、实验探究题
-
17. 小宁进行下列实验时未能达到预期目标,请根据所学知识回答问题。(1)、做氢气还原氧化铜实验时,反应结束后,试管内红色物质又变黑了。产生这个现象的原因是。(2)、在做酸碱中和反应实验时,小宁将一定量的稀盐酸和氢氧化钠溶液混合,没看到明显现象。用手触摸试管外壁,微热,确定两者发生了反应。下列实验能证明两者恰好完全反应的是____。A、加入镁粉,没有气体生成 B、加入氢氧化铜固体,生成蓝色溶液 C、测得该溶液的pH=7 D、滴入酚酞试液,溶液不变色(3)、在验证铝和铜的金属活动性强弱的实验中,小宁把一根铝丝浸入一定量的硫酸铜溶液中,没看到明显现象。原因是把铝丝浸入到硫酸铜溶液前,小宁遗漏了一步实验操作:。18. 科学兴趣小组在实验时发现了一个有趣的现象:红色的火柴头燃烧过后能被磁铁吸引,如图所示。为了研究这一现象,同学们对燃烧后火柴头的成分进行了如下探究:

【查阅资料】
资料一:火柴头中含有氯酸钾、硫磺、二氧化锰,以及石蜡、炭粉等成分;一般红色火柴头所用的着色剂为氧化铁。
资料二:氧化铁不具有磁性,不能被磁化;四氧化三铁是具有磁性的黑色固体,故又称为磁性氧化铁
【建立假设】
假设一:燃烧后的火柴头成分中含有四氧化三铁。
假设二:燃烧后的火柴头成分中含有单质铁。
假设三:燃烧后的火柴头成分中含有四氧化三铁和单质铁。
(1)、同学们认为其成分中含有单质铁的依据是(用化学方程式表示)。(2)、【收集证据】步骤①:将燃烧后的火柴头研磨成粉末并装入试管;
步骤②:在试管中加入足量CuSO4溶液,充分反应。
步骤③:过滤并将得到的固体充分干燥,再用磁铁吸引。
【得出结论】
若假设三成立,则作为证据的实验现象应为。
(3)、【拓展提高】尝试用科学原理解释火柴头中加入氯酸钾的目的。
19. 工业上用铝土矿(含有Al2O3、SiO2 , 不考虑其它杂质)制取金属铝的基本流程如图所示: (1)、滤液Ⅰ中含有的阳离子是(写离子符号)。(2)、Al2O3通电后产物是两种单质,写出该反应的化学方程式。(3)、在生活中铝制品比铁抗腐蚀性好,原因是。20. “一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素”,这是某教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。
(1)、滤液Ⅰ中含有的阳离子是(写离子符号)。(2)、Al2O3通电后产物是两种单质,写出该反应的化学方程式。(3)、在生活中铝制品比铁抗腐蚀性好,原因是。20. “一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素”,这是某教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。【查阅资料】钠常温下就能与水发生剧烈反应,反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表中所示。
实验编号
钠块大小
硫酸铜溶液
实验中产生沉淀的现象
①
绿豆大小
稀溶液10mL
产生蓝绿色沉淀
②
绿豆大小
浓溶液10mL
产生蓝色絮状沉淀
③
豌豆大小
稀溶液10mL
产生蓝色絮状沉淀
④
豌豆大小
浓溶液10mL
产生蓝色絮状沉淀,并出现黑色固体
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
【实验结论】
(1)、上述实验中均未观察到色固体生成,由此判断猜想一错误。(2)、实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。【实验反思】实验中生成氢氧化铜沉淀的原理是(用化学方程式表示)。
(3)、由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有。