2024年中考化学三轮冲刺专项训练--溶液及溶解度曲线
试卷更新日期:2024-05-20 类型:三轮冲刺
一、选择题
-
1. 少量下列物质与水充分混合,能得到溶液的是( )A、蔗糖 B、面粉 C、植物油 D、冰块2. 为制作叶脉书签,某同学在实验室配制10%的NaOH溶液,部分操作如下,其中正确的是( )A、取用NaOH
 B、称量NaOH
B、称量NaOH  C、量取所需的水
C、量取所需的水 D、读取水的体积
D、读取水的体积 3. 图1为和两种固体的溶解度曲线,根据图1、图2分析,下列说法正确的是( )
3. 图1为和两种固体的溶解度曲线,根据图1、图2分析,下列说法正确的是( ) A、点处和两种溶液中溶质的质量相等 B、点处溶液中溶质的质量分数为 C、时,分别将和的饱和溶液恒温蒸发等质量的水,析出固体的质量多 D、图2中“某一步操作”前后的溶液状态变化过程可以在图1表示为点点4. 甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A、点处和两种溶液中溶质的质量相等 B、点处溶液中溶质的质量分数为 C、时,分别将和的饱和溶液恒温蒸发等质量的水,析出固体的质量多 D、图2中“某一步操作”前后的溶液状态变化过程可以在图1表示为点点4. 甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( ) A、降温可使丙物质的不饱和溶液变成饱和溶液 B、t2℃时,等质量甲、乙、丙的饱和溶液中溶剂的质量:甲>乙>丙 C、欲除去甲溶液中少量的乙物质,常采用蒸发结晶的方法 D、分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,所得溶液溶质的质量分数:乙>甲>丙5. 下列有关水与溶液的说法错误的是( )A、硬水与软水可以用肥皂水鉴别 B、天然淡水生产自来水需要经过沉降、过滤、杀菌消毒等净化过程 C、溶液具有均一性和稳定性,因为溶液中各种粒子保持静止不动 D、用量筒取50mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏大6. 如图是某同学探究燃烧条件的改装装置,往烧杯中加入下列哪种物质,能引起白磷燃烧的是( )
A、降温可使丙物质的不饱和溶液变成饱和溶液 B、t2℃时,等质量甲、乙、丙的饱和溶液中溶剂的质量:甲>乙>丙 C、欲除去甲溶液中少量的乙物质,常采用蒸发结晶的方法 D、分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,所得溶液溶质的质量分数:乙>甲>丙5. 下列有关水与溶液的说法错误的是( )A、硬水与软水可以用肥皂水鉴别 B、天然淡水生产自来水需要经过沉降、过滤、杀菌消毒等净化过程 C、溶液具有均一性和稳定性,因为溶液中各种粒子保持静止不动 D、用量筒取50mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏大6. 如图是某同学探究燃烧条件的改装装置,往烧杯中加入下列哪种物质,能引起白磷燃烧的是( )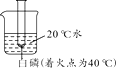 A、硝酸铵 B、氢氧化钠 C、蔗糖 D、食盐7. 20℃时,向盛有100g水的烧杯中加入60 g ZnSO4进行实验(忽略水的蒸发)。依据下图所示的实验和ZnSO4溶解度曲线,下列说法正确的是( )
A、硝酸铵 B、氢氧化钠 C、蔗糖 D、食盐7. 20℃时,向盛有100g水的烧杯中加入60 g ZnSO4进行实验(忽略水的蒸发)。依据下图所示的实验和ZnSO4溶解度曲线,下列说法正确的是( )
 A、20℃时,充分搅拌后烧杯中溶液的质量为160g B、升温到40℃时,烧杯中的溶液为饱和溶液 C、从60℃升温到80℃时,烧杯内溶液中溶质的质量分数减小 D、100℃时,烧杯内溶液中溶质的质量分数为37.5%8. 向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量.小烧杯中有关量的变化情况见下图.其中肯定不正确的是( )A、
A、20℃时,充分搅拌后烧杯中溶液的质量为160g B、升温到40℃时,烧杯中的溶液为饱和溶液 C、从60℃升温到80℃时,烧杯内溶液中溶质的质量分数减小 D、100℃时,烧杯内溶液中溶质的质量分数为37.5%8. 向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量.小烧杯中有关量的变化情况见下图.其中肯定不正确的是( )A、 B、
B、 C、
C、 D、
D、 9. 甲、乙,丙三种均不含结晶水的固体物质溶解度曲线如下图所示,则下列说法错误的是( )
9. 甲、乙,丙三种均不含结晶水的固体物质溶解度曲线如下图所示,则下列说法错误的是( )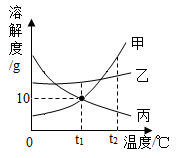 A、在t1℃时甲和丙的饱和溶液溶质质量分数相等 B、在t2℃时三种物质的溶解度大小关系是:甲>乙>丙 C、等质量甲,乙两种物质的溶液从t2℃降到t1℃时,析出晶体最多的是甲溶液 D、三种物质的饱和溶液从t2℃降列t1℃,所得溶液的溶质质量分数:乙>甲>丙10. 甲、乙、丙三种物质的溶解度曲线如图所示。下列说法正确的是( )
A、在t1℃时甲和丙的饱和溶液溶质质量分数相等 B、在t2℃时三种物质的溶解度大小关系是:甲>乙>丙 C、等质量甲,乙两种物质的溶液从t2℃降到t1℃时,析出晶体最多的是甲溶液 D、三种物质的饱和溶液从t2℃降列t1℃,所得溶液的溶质质量分数:乙>甲>丙10. 甲、乙、丙三种物质的溶解度曲线如图所示。下列说法正确的是( ) A、丙一定是气体物质 B、若甲中混有少量的乙,可用蒸发结晶的方法提纯甲 C、t1℃时,将8克乙物质放入25克水中,充分溶解可获得33克乙溶液 D、t2℃时,将等质量的甲、乙两种物质的饱和溶液降温至t1℃,溶剂质量的大小关系:甲<乙11. 如图是氯化镁和硫酸镁的溶解度曲线(不考虑水分蒸发),下列说法正确的是( )
A、丙一定是气体物质 B、若甲中混有少量的乙,可用蒸发结晶的方法提纯甲 C、t1℃时,将8克乙物质放入25克水中,充分溶解可获得33克乙溶液 D、t2℃时,将等质量的甲、乙两种物质的饱和溶液降温至t1℃,溶剂质量的大小关系:甲<乙11. 如图是氯化镁和硫酸镁的溶解度曲线(不考虑水分蒸发),下列说法正确的是( )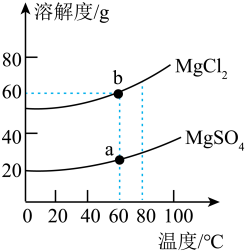 A、将a点的硫酸镁溶液降温至20℃时,无晶体析出 B、60℃时,向50g水中加入20g硫酸镁搅拌,得70g溶液 C、b点氯化镁溶液属于不饱和溶液 D、将b点的氯化镁溶液升温至80℃时,溶液浓度不变12. 和的溶解度如下表,溶解度曲线如下图。下列说法正确的是( )
A、将a点的硫酸镁溶液降温至20℃时,无晶体析出 B、60℃时,向50g水中加入20g硫酸镁搅拌,得70g溶液 C、b点氯化镁溶液属于不饱和溶液 D、将b点的氯化镁溶液升温至80℃时,溶液浓度不变12. 和的溶解度如下表,溶解度曲线如下图。下列说法正确的是( )温度/
0
10
20
30
40
50
60
溶解度/g
13.3
20.9
31.6
45.8
63.9
85.5
110
27.6
31.0
34.0
37.0
40.0
42.6
45.5
 A、曲线甲代表的溶解度曲线 B、时,饱和溶液的溶质质量分数为85.5% C、由表中数据可知,的值在之间 D、将时,甲、乙的饱和溶液分别降温至 , 溶液的质量:甲>乙13. 将固体X加入水中,实验现象如图所示,下列说法正确的是( )
A、曲线甲代表的溶解度曲线 B、时,饱和溶液的溶质质量分数为85.5% C、由表中数据可知,的值在之间 D、将时,甲、乙的饱和溶液分别降温至 , 溶液的质量:甲>乙13. 将固体X加入水中,实验现象如图所示,下列说法正确的是( ) A、X是 , Y是 B、X是NaOH,Y是 C、X是CaO,Y是水 D、X是 , Y是14. 晾晒海水 制盐在我国有着悠久的历史,利用该工 艺可得到氯化钠和氯化镁等物质。 氯化钠钠和氯化镁的溶解度曲线如图,下列说温度/℃法正确的是 ( )
A、X是 , Y是 B、X是NaOH,Y是 C、X是CaO,Y是水 D、X是 , Y是14. 晾晒海水 制盐在我国有着悠久的历史,利用该工 艺可得到氯化钠和氯化镁等物质。 氯化钠钠和氯化镁的溶解度曲线如图,下列说温度/℃法正确的是 ( ) A、海水晒盐利用了蒸发结晶的方法获得晶体 B、氯化钠的溶解度受温度影响较大 C、t℃时,氯化镁饱和溶液中溶质质量分数为70% D、采用降温结晶的方法可除去氯化钠饱和溶液中少量的氯化镁杂质15. 遂宁某中学举办“理科节”主题活动,杨阳同学表演了一个魔术——“多变的气球”。雅菲用所学知识选择下表4组物质设计如图所示的模拟实验,推测气球变化的现象并分析原理(假设过程中,装置气密性良好;忽略固体和液体的体积变化),现象推测和原理分析都正确的个数有( )
A、海水晒盐利用了蒸发结晶的方法获得晶体 B、氯化钠的溶解度受温度影响较大 C、t℃时,氯化镁饱和溶液中溶质质量分数为70% D、采用降温结晶的方法可除去氯化钠饱和溶液中少量的氯化镁杂质15. 遂宁某中学举办“理科节”主题活动,杨阳同学表演了一个魔术——“多变的气球”。雅菲用所学知识选择下表4组物质设计如图所示的模拟实验,推测气球变化的现象并分析原理(假设过程中,装置气密性良好;忽略固体和液体的体积变化),现象推测和原理分析都正确的个数有( )物质m
物质n
现象推测
原理分析
①
稀硫酸
锌粉
逐渐鼓起并保持
Zn+H2SO4═ZnSO4+H2↑
反应产生气体,内压保持不变
②
水
硝酸铵固体
逐渐变瘪并保持
硝酸铵溶于水,温度降低,内压减小并保持
③
氢氧化钠溶液
二氧化碳
逐渐变瘪并保持
2NaOH+CO2═Na2CO3+H2O
反应消耗气体,内压减小并保持
④
水
生石灰
逐渐鼓起,慢慢恢复
CaO+H2O═Ca(OH)2反应放热,温度升高,反应结束一段时间后恢复常温,内压先增大后恢复
 A、1 B、2 C、3 D、416. 20℃时,食盐的溶解度是36g,将40g食盐放入100g水中,所得溶液的质量为( )A、40g B、140g C、136g D、100g17. 如图为Na2CO3和NH4HCO3的溶解度曲线。下列说法正确的是( )
A、1 B、2 C、3 D、416. 20℃时,食盐的溶解度是36g,将40g食盐放入100g水中,所得溶液的质量为( )A、40g B、140g C、136g D、100g17. 如图为Na2CO3和NH4HCO3的溶解度曲线。下列说法正确的是( )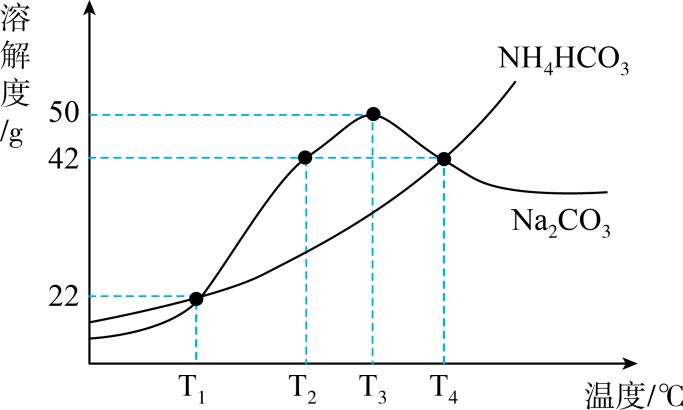 A、T1℃时,将30gNH4HCO3加到50g水中,NH4HCO3完全溶解 B、T2℃的Na2CO3饱和溶液升温到T3℃,溶质质量分数不变 C、将100gNa2CO3溶液从T4℃降温到T1℃,一定析出Na2CO3晶体 D、将T1℃的两物质饱和溶液升温到T4℃,为使溶液恰好饱和,加入两固体质量一定相等18. 硝酸钾的溶解度曲线如图所示,a、b、c三点对应的溶液分别是用100g水配制的硝酸钾溶液。下列说法正确的是( )
A、T1℃时,将30gNH4HCO3加到50g水中,NH4HCO3完全溶解 B、T2℃的Na2CO3饱和溶液升温到T3℃,溶质质量分数不变 C、将100gNa2CO3溶液从T4℃降温到T1℃,一定析出Na2CO3晶体 D、将T1℃的两物质饱和溶液升温到T4℃,为使溶液恰好饱和,加入两固体质量一定相等18. 硝酸钾的溶解度曲线如图所示,a、b、c三点对应的溶液分别是用100g水配制的硝酸钾溶液。下列说法正确的是( )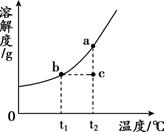 A、溶质的质量分数:a>b>c B、由b→c需加入一定量的水 C、由c→a需加入适量硝酸钾 D、a、b、c三点对应的溶液均为饱和溶液19. 如图曲线是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
A、溶质的质量分数:a>b>c B、由b→c需加入一定量的水 C、由c→a需加入适量硝酸钾 D、a、b、c三点对应的溶液均为饱和溶液19. 如图曲线是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( ) A、20℃时,甲、乙两种固体物质的溶解度都是30 B、40℃时,甲的饱和溶液中溶质质量分数为50% C、将40℃时甲、乙的饱和溶液分别降温到20℃,所得溶液的溶质质量分数相同 D、将20℃甲的饱和溶液升温到40℃,有固体析出20. 把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量( )A、800g B、880g C、980g D、98g21. 甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如下图所示。下列说法正确的是( )
A、20℃时,甲、乙两种固体物质的溶解度都是30 B、40℃时,甲的饱和溶液中溶质质量分数为50% C、将40℃时甲、乙的饱和溶液分别降温到20℃,所得溶液的溶质质量分数相同 D、将20℃甲的饱和溶液升温到40℃,有固体析出20. 把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量( )A、800g B、880g C、980g D、98g21. 甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如下图所示。下列说法正确的是( ) A、甲的溶解度大于乙的溶解度 B、甲中混有少量乙时,可用蒸发溶剂的方法提纯甲 C、t3℃时,将等质量的甲、乙、丙的溶液降温到t1℃时,析出晶体最多的是甲的溶液 D、t1℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙22. 逻辑推理是一种重要的化学思维方法。下列推理中,正确的是( )A、铝比铁更活泼,所以通常情况下铝制品比铁制品更易被腐蚀 B、洗涤剂去油污是利用了乳化作用,所以汽油去油污也是利用了乳化作用 C、一种元素可以有多种化合价,所以同一化学式中的同种元素可能会有不同化合价 D、活泼金属和稀盐酸反应放出气体,所以能和稀盐酸反应放出气体的一定是活泼金属23. t1℃时,将等质量的硝酸钾和氯化钾分别加入到盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示,下列说法错误的是( )
A、甲的溶解度大于乙的溶解度 B、甲中混有少量乙时,可用蒸发溶剂的方法提纯甲 C、t3℃时,将等质量的甲、乙、丙的溶液降温到t1℃时,析出晶体最多的是甲的溶液 D、t1℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙22. 逻辑推理是一种重要的化学思维方法。下列推理中,正确的是( )A、铝比铁更活泼,所以通常情况下铝制品比铁制品更易被腐蚀 B、洗涤剂去油污是利用了乳化作用,所以汽油去油污也是利用了乳化作用 C、一种元素可以有多种化合价,所以同一化学式中的同种元素可能会有不同化合价 D、活泼金属和稀盐酸反应放出气体,所以能和稀盐酸反应放出气体的一定是活泼金属23. t1℃时,将等质量的硝酸钾和氯化钾分别加入到盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示,下列说法错误的是( ) A、烧杯①中溶解的溶质是氯化钾 B、烧杯②中的上层清液属于饱和溶液 C、将t1℃时50g硝酸钾的饱和溶液稀释成5%的溶液,需加水150g D、t1℃时,将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体24. 下列图象能正确反映对应变化关系的是( )
A、烧杯①中溶解的溶质是氯化钾 B、烧杯②中的上层清液属于饱和溶液 C、将t1℃时50g硝酸钾的饱和溶液稀释成5%的溶液,需加水150g D、t1℃时,将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体24. 下列图象能正确反映对应变化关系的是( )



A.20℃时,向一定量硝酸钾不饱和溶液中加入硝酸钾固体
B.向一定量NaOH溶液中加稀盐酸
C.电解水
D.向盛有少量二氧化锰的烧杯中不断加入溶液
A、A B、B C、C D、D25. 下列图像能正确反映对应变化关系的是( ) A、用红磷燃烧测定空气里氧气的含量 B、高温条件下,向一定量的氧化铁中通入一氧化碳 C、向和混合溶液中逐滴滴加稀盐酸 D、向等质量的水中分别加入等质量的氢氧化钠和硝酸铵固体
A、用红磷燃烧测定空气里氧气的含量 B、高温条件下,向一定量的氧化铁中通入一氧化碳 C、向和混合溶液中逐滴滴加稀盐酸 D、向等质量的水中分别加入等质量的氢氧化钠和硝酸铵固体二、填空题
-
26. 如图是初中化学常见的几个实验。
 (1)、甲是探究物质溶解性的实验。实验中碘几乎不溶于水却能溶解在汽油中,说明物质的溶解性与有关。(2)、乙是探究燃烧条件的实验。实验中能燃烧的是(选填“a”、“b”或“c”)处物质,根据现象,可得出燃烧的条件之一是需要氧气。(3)、丙是证明某氢氧化钠溶液变质情况的实验。试管①中溶液变红,试管②中加入的试剂X是 , 观察到 , 则说明氢氧化钠是全部变质。27. 了解实验注意事项,规范操作,能更好完成实验。(1)、实验室药品的取用要严格按照实验规定的用量取用;若没有说明用量,一般应按最少量取用:液体取mL,固体只需。(2)、给液体加热时,试管内液体的体积不超过试管容积的。(3)、夏敏用托盘天平称取食盐,见下图,所称食盐的质量为g,若食盐与砝码的位置放颠倒了,读数仍如图所示,则称取食盐的实际质量为g。要称取一定质量的食盐,正确称量时,若称取过程中指针偏右,应采取的措施是(填字母序号)。
(1)、甲是探究物质溶解性的实验。实验中碘几乎不溶于水却能溶解在汽油中,说明物质的溶解性与有关。(2)、乙是探究燃烧条件的实验。实验中能燃烧的是(选填“a”、“b”或“c”)处物质,根据现象,可得出燃烧的条件之一是需要氧气。(3)、丙是证明某氢氧化钠溶液变质情况的实验。试管①中溶液变红,试管②中加入的试剂X是 , 观察到 , 则说明氢氧化钠是全部变质。27. 了解实验注意事项,规范操作,能更好完成实验。(1)、实验室药品的取用要严格按照实验规定的用量取用;若没有说明用量,一般应按最少量取用:液体取mL,固体只需。(2)、给液体加热时,试管内液体的体积不超过试管容积的。(3)、夏敏用托盘天平称取食盐,见下图,所称食盐的质量为g,若食盐与砝码的位置放颠倒了,读数仍如图所示,则称取食盐的实际质量为g。要称取一定质量的食盐,正确称量时,若称取过程中指针偏右,应采取的措施是(填字母序号)。
A.将螺母向左调 B.取下一部分砝码 C.向左盘添加氯化钠 D.将螺母向右调
(4)、某同学用50mL量筒仰视量取47mL水,判断他所量取到的体积实际是(填大于、等于或小于)47mL。28. 某兴趣小组用硝酸钾进行了图甲所示的实验,硝酸钾溶解度与温度的关系如图乙。
 (1)、10℃时,硝酸钾的溶解度是 克;(2)、②中硝酸钾溶液是 (选填“饱和”或“不饱和”)溶液;(3)、通过查阅资料知道氯化钠的溶解度受温度影响较小。从硝酸钾溶液(含有少量氯化钠)中提纯硝酸钾的方法是 结晶。29. 盐湖是自然界天然存在的溶液。在数千年的文明发展中,人们形成许多关于盐湖的认识,掌握了一系列采盐、用盐常识。其中就有“冬天捞碱,夏天晒盐”的传统。
(1)、10℃时,硝酸钾的溶解度是 克;(2)、②中硝酸钾溶液是 (选填“饱和”或“不饱和”)溶液;(3)、通过查阅资料知道氯化钠的溶解度受温度影响较小。从硝酸钾溶液(含有少量氯化钠)中提纯硝酸钾的方法是 结晶。29. 盐湖是自然界天然存在的溶液。在数千年的文明发展中,人们形成许多关于盐湖的认识,掌握了一系列采盐、用盐常识。其中就有“冬天捞碱,夏天晒盐”的传统。【资料】下表是氯化钠和碳酸钠在不同温度下的溶解度。
温度(℃)
0
10
20
30
40
溶解度(g/100g水)
Na2CO3
7.0
12.5
21.8
39.7
48.8
NaCl
35.7
35.8
36.0
36.3
36.6
(1)、模拟“冬天捞碱”:进行如下实验(降温至0℃,溶液不会凝固;假设析出的物质不含结晶水),将实验流程补充完整并进行相关分析。
①a溶液中的溶剂是水,水中氢、氧元素的质量比为。
②操作Ⅰ的名称是。
③定量分析固体c的成分是(写出各组分及其质量)。
(2)、夏天晒盐:从盐湖中提取食盐的生产流程如下:
①从上述流程可知,“夏日晒盐”是通过(选填“蒸发结晶”或“降温结晶”)实现的。
②常温下,析出粗盐晶体后的母液,对于氯化钠来说是(填“饱和”或“不饱和”)溶液。
三、实验探究题
-
30. 某化学兴趣小组开展碱的化学性质系列探究实验,请完成下列问题。(1)、Ⅰ.分析碱的化学性质(如图1)
实验A中,推入溶液后,可观察到的现象是; (2)、实验C中发生反应的化学方程式是;
(2)、实验C中发生反应的化学方程式是;实验结束后,小组同学对B试管中上层清液的溶质成分产生疑问,作出猜想:
猜想一:只含有
猜想二:含有、
猜想三:、
(3)、同学们取少量B试管中的清液分别置于甲、乙两支试管中,进行探究:实验结论
实验现象
实验操作
在试管甲中滴加足量稀盐酸
无气泡产生
猜想不成立
在试管乙中滴加碳酸钠溶液
猜想三成立
(4)、Ⅱ.利用传感器探究:氢氧化钠溶液与稀盐酸发生酸碱中和反应的过程中温度和的变化,实验操作及测定结果如图2所示。
图丙表明酸和碱的反应为(填“吸热”或“放热”)反应。
(5)、写出氢氧化钠和稀盐酸反应的化学方程式。(6)、图乙中c点的溶液中溶质为(填化学式)。下列试剂中,不能验证出反应后溶液处于乙图c点的是(填序号)A.试纸 B.硝酸银溶液 C.碳酸钙