北京市重点学校2024年3月中考一模化学试卷
试卷更新日期:2024-05-14 类型:中考模拟
一、本部分共25题,每题1分,共25分。在每题列出的四个选项中,选出最符合题目要求的一项。
-
1. 空气成分中,体积分数最大的是( )A、氮气 B、氧气 C、稀有气体 D、二氧化碳2. 下列不属于化石燃料的是( )A、石油 B、煤 C、乙醇 D、天然气3. 化学元素与人体健康密切相关。为了防止骨质疏松应适当摄入的元素是( )A、钙 B、铁 C、锌 D、硒4. 下列是生活中常见物质的pH范围,其中呈碱性的是( )A、食醋(2.8~3.8) B、酱油(4.0~5.0) C、鲜牛奶(6.3~6.6) D、鸡蛋清(7.6~8.0)5. 炉具清洁剂中含氢氧化钠,下面是氢氧化钠俗称的是( )A、小苏打 B、纯碱 C、烧碱 D、生石灰6. 如图所示的图标表示( )
 A、禁止吸烟 B、禁止烟火 C、禁止燃放鞭炮 D、禁止堆放易燃物7. 切洋葱时可闻到刺激性气味,这说明( )A、分子在不断运动 B、分子的质量很小 C、分子之间有间隔 D、分子的体积很小8. 下列物质的用途不正确的是( )A、用作气体肥料 B、熟石灰用于改良酸性土壤 C、用浓硫酸作食品干燥剂 D、用稀有气体作电光源9. 地壳中含量最多的元素是( )A、氧 B、硅 C、铝 D、铁10. 氢元素与氧元素的本质区别是( )A、质子数不同 B、中子数不同 C、核外电子数不同 D、最外层电子数不同11. 我国科学家成功研制用于外太空核反应堆的高强韧钼合金。钼元素在元素周期表中的信息如图所示。下列有关钼元素的说法不正确的是( )
A、禁止吸烟 B、禁止烟火 C、禁止燃放鞭炮 D、禁止堆放易燃物7. 切洋葱时可闻到刺激性气味,这说明( )A、分子在不断运动 B、分子的质量很小 C、分子之间有间隔 D、分子的体积很小8. 下列物质的用途不正确的是( )A、用作气体肥料 B、熟石灰用于改良酸性土壤 C、用浓硫酸作食品干燥剂 D、用稀有气体作电光源9. 地壳中含量最多的元素是( )A、氧 B、硅 C、铝 D、铁10. 氢元素与氧元素的本质区别是( )A、质子数不同 B、中子数不同 C、核外电子数不同 D、最外层电子数不同11. 我国科学家成功研制用于外太空核反应堆的高强韧钼合金。钼元素在元素周期表中的信息如图所示。下列有关钼元素的说法不正确的是( ) A、属于金属元素 B、原子序数为42 C、相对原子质量为95.96g D、原子中核外电子数为4212. 下列符号表示两个氯原子的是( )A、 B、 C、 D、13. 下列铜制品主要利用其化学性质的是( )A、导线
A、属于金属元素 B、原子序数为42 C、相对原子质量为95.96g D、原子中核外电子数为4212. 下列符号表示两个氯原子的是( )A、 B、 C、 D、13. 下列铜制品主要利用其化学性质的是( )A、导线 B、火锅
B、火锅 C、耐酸阀门
C、耐酸阀门 D、乐器
D、乐器 14. 下列标签中化学式与名称不符的是( )A、氢氧化钾 B、氯化亚铁 C、硫酸铜 D、氧化镁15. 我国科学家以为原料人工合成葡萄糖()。下列有关葡萄糖的说法正确的是( )A、由24个原子构成 B、碳元素的质量分数最大 C、由三种元素组成 D、碳、氢元素质量比为16. 从海带中提取碘单质()的反应为 , 该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应17. 溶液在生产生活科研中应用广泛,请回答各题。(1)、下列属于溶液的是( )A、泥浆 B、蔗糖水 C、牛奶 D、蒸馏水(2)、用溶液喷洒路面可融雪、防尘。时,按下表数据配制溶液,回答问题。
14. 下列标签中化学式与名称不符的是( )A、氢氧化钾 B、氯化亚铁 C、硫酸铜 D、氧化镁15. 我国科学家以为原料人工合成葡萄糖()。下列有关葡萄糖的说法正确的是( )A、由24个原子构成 B、碳元素的质量分数最大 C、由三种元素组成 D、碳、氢元素质量比为16. 从海带中提取碘单质()的反应为 , 该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应17. 溶液在生产生活科研中应用广泛,请回答各题。(1)、下列属于溶液的是( )A、泥浆 B、蔗糖水 C、牛奶 D、蒸馏水(2)、用溶液喷洒路面可融雪、防尘。时,按下表数据配制溶液,回答问题。(已知:时,的溶解度为)
序号
①
②
③
④
的质量/g
30
40
50
60
水的质量/
100
100
100
100
所得溶液中,溶质与溶剂的质量比为的是( )
A、① B、② C、③ D、④(3)、①中溶质的质量分数约为( )A、 B、 C、 D、(4)、所得溶液中,属于饱和溶液的是( )A、① B、② C、③ D、④18. 下列操作不正确的是( )A、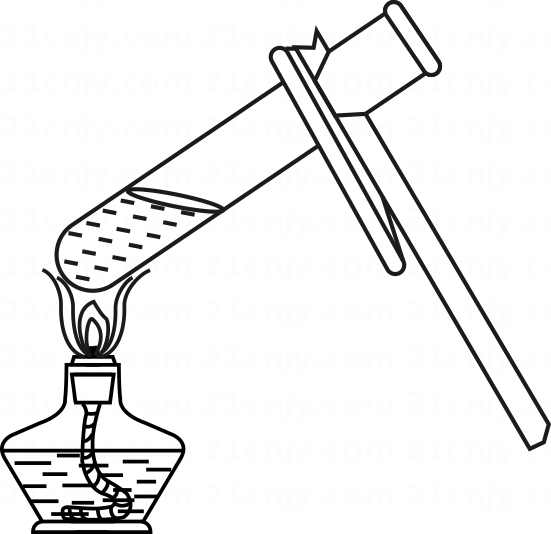 加热液体
B、
加热液体
B、 稀释浓硫酸
C、
稀释浓硫酸
C、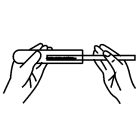 取固体粉末
D、
取固体粉末
D、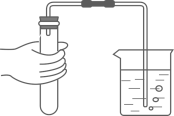 检查气密性
19. 电解水实验如图。下列说法不正确的是( )
检查气密性
19. 电解水实验如图。下列说法不正确的是( ) A、试管1中得到H2 B、水由H2、O2组成 C、产生H2和O2的体积比为2:1 D、实验说明水分子是可分的20. 用下图装置进行实验。下列现象能证明空气中含量的是( )
A、试管1中得到H2 B、水由H2、O2组成 C、产生H2和O2的体积比为2:1 D、实验说明水分子是可分的20. 用下图装置进行实验。下列现象能证明空气中含量的是( ) A、红磷燃烧,产生白烟 B、水槽中液面下降 C、瓶中液面先下降,后上升 D、瓶中液面最终上升至1处21. 用下图装置探究可燃物燃烧的条件,图1铜片上白磷和图2水中白磷发生燃烧。下列结论不正确的是( )
A、红磷燃烧,产生白烟 B、水槽中液面下降 C、瓶中液面先下降,后上升 D、瓶中液面最终上升至1处21. 用下图装置探究可燃物燃烧的条件,图1铜片上白磷和图2水中白磷发生燃烧。下列结论不正确的是( )图1
 图2
图2  A、烧杯中热水的作用之一是使白磷达到燃烧所需的温度 B、对比铜片上的白磷、红磷发生的现象,说明可燃物燃烧温度要达到着火点 C、对比铜片上红磷、水中白磷发生的现象,说明可燃物燃烧要与氧气接触 D、对比水中白磷通氧气前后发生的现象,说明可燃物燃烧要与氧气接触22. 某反应前后分子种类变化的微观示意图如下。下列说法不正确的是( )
A、烧杯中热水的作用之一是使白磷达到燃烧所需的温度 B、对比铜片上的白磷、红磷发生的现象,说明可燃物燃烧温度要达到着火点 C、对比铜片上红磷、水中白磷发生的现象,说明可燃物燃烧要与氧气接触 D、对比水中白磷通氧气前后发生的现象,说明可燃物燃烧要与氧气接触22. 某反应前后分子种类变化的微观示意图如下。下列说法不正确的是( ) A、甲、丙为空气污染物 B、丙中氮、氧元素质量比为7:16 C、反应前后氧原子个数相等 D、参加反应的甲和乙的分子个数比为1:1
A、甲、丙为空气污染物 B、丙中氮、氧元素质量比为7:16 C、反应前后氧原子个数相等 D、参加反应的甲和乙的分子个数比为1:1二、非选择题(共45分)
-
23. 【生活现象解释】
共享单车以绿色、节能、便捷等优势受到大家的青睐。
(1)、图中所示自行车部件中,属于有机合成材料的是____(填字母序号)。 A、钢铁骨架 B、塑料外壳 C、合成橡胶轮胎(2)、制造车体需要大量的钢铁,写出用和反应炼铁的化学方程式。(3)、为防止共享单车的车架与空气中的接触而生锈,通常进行喷漆处理。24. 常见食品干燥剂的主要成分如下表。
A、钢铁骨架 B、塑料外壳 C、合成橡胶轮胎(2)、制造车体需要大量的钢铁,写出用和反应炼铁的化学方程式。(3)、为防止共享单车的车架与空气中的接触而生锈,通常进行喷漆处理。24. 常见食品干燥剂的主要成分如下表。干燥剂
生石灰干燥剂
硫酸钙干燥剂
主要成分
CaO
CaSO4
(1)、其中属于氧化物的是(填化学式)。(2)、生石灰干燥剂吸水后转化为氢氧化钙,反应的化学方程式为。25. 氧气曾叫做“养气”,说明氧气的重要性。(1)、氧气可用于医疗急救,是因为氧气能。(2)、工业生产常用铁管输送氧气。①铁属于(填“单质”或“化合物”)。
②若管道阀门使用不当,会造成铁管剧烈燃烧爆炸,反应的化学方程式为。
26. 【科普阅读理解】阅读下面科普短文。
可可树的果实可可豆是制作巧克力的原料,直接食用苦涩味极重,让我们来了解一下它是如何蜕变成巧克力的。
发酵:将大量可可豆堆积在一起,持续一两周时间,果肉在微生物作用下开始发酵,内部温度不断升高。在此过程中,种子失去了生物活性,发酵产生的酸与醇发生酯化反应,生成了带有果香味的物质。
晾晒:除去可可豆中多余的水分。
烘烤:可可豆内部的碳水化合物开始受热分解,类似于用锅加热蔗糖,碳水化合物逐渐焦糖化,颜色由白转棕。在不同温度下,一定量蔗糖焦糖化程度变化如图1。温度更高时,糖与蛋白质发生美拉德反应,形成大量具有香气的分子。
分离后混合:将烘烤后的可可豆进行压滤,分离出可可脂(熔点约),同时得到压碎的可可粉。将可可粉、可可脂、糖混合便得到了巧克力。的黑巧克力就是将可可脂、可可粉、糖混合制成的(以质量分数记)。某款巧克力的营养成分如图2。
巧克力味道令人愉悦,但能量密度极大,食用需适量。
图1
 图2:营养成分
图2:营养成分
依据文章内容回答下列问题。
(1)、可可树果实发酵的过程属于(填“物理变化”或“化学变化”)。(2)、对比图1中的两条曲线,得出的结论是:时间在0~t范围内,当反应时间相同时,。(3)、由图2可知,该款巧克力中含量最多的营养素是。(4)、判断下列说法是否正确(填“对”或“错”)。①巧克力入口即化,与可可脂熔点和体温接近有关。。
②每的黑巧克力含有可可脂。。
27. 【生产实际分析】钛及其合金大量用于航空工业。利用钛铁矿()制备钛的主要转化过程如下:
已知:焦炭的成分为C、、。
(1)、步骤①中常将钛铁矿进行粉粹,其目的是。(2)、中钛元素的化合价为。(3)、②中发生置换反应的化学方程式为。28. 利用燃煤电厂的粉煤灰提取氧化铝的主要工艺流程如下图。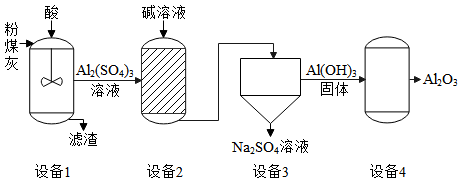 (1)、设备1中加入的酸是。(2)、设备3中的分离操作是。(3)、设备4中发生反应的化学方程式为2Al(OH)3Al2O3 + 3X,则X的化学式为。29. 用下列装置进行O2和CO2的实验。
(1)、设备1中加入的酸是。(2)、设备3中的分离操作是。(3)、设备4中发生反应的化学方程式为2Al(OH)3Al2O3 + 3X,则X的化学式为。29. 用下列装置进行O2和CO2的实验。 (1)、A用于制备O2 , 药品X为(写化学式)。(2)、B中木炭燃烧的现象为。(3)、C中生成CO2的反应的化学方程式为 , 湿润紫色石蕊小花先变红的是(填“a”或“b”)。30. 配制溶质质量分数为的溶液,实验操作如下:
(1)、A用于制备O2 , 药品X为(写化学式)。(2)、B中木炭燃烧的现象为。(3)、C中生成CO2的反应的化学方程式为 , 湿润紫色石蕊小花先变红的是(填“a”或“b”)。30. 配制溶质质量分数为的溶液,实验操作如下: (1)、正确的操作顺序是。(2)、④中用玻璃棒搅拌的目的是。(3)、配制完成后装瓶、贴标签,在下图的标签中填上相应的内容。
(1)、正确的操作顺序是。(2)、④中用玻璃棒搅拌的目的是。(3)、配制完成后装瓶、贴标签,在下图的标签中填上相应的内容。 31. 进行如下实验,研究金属的性质。补全实验报告。
31. 进行如下实验,研究金属的性质。补全实验报告。序号
操作或装置
现象
结论或解释
(1)

黄铜片在纯铜片表面刻画出明显痕迹
黄铜的硬度比纯铜(填“大”或“小”)
(2)

铁的金属活动性比铜强
(3)
 (补全B装置图)
(补全B装置图)A、B中均无明显变化,C中铁钉表面有红色固体生成
铁与氧气和水同时接触时易生锈
32. 用如图实验研究盐酸的化学性质。向点滴板的6个孔穴中分别滴入足量稀盐酸。 (1)、1-3中有明显现象的是(填序号)。(2)、4中的现象为。(3)、孔穴5中测得反应后溶液的为2,则反应后溶液中的溶质有。(4)、6中加入的X与盐酸发生置换反应,选择X并写出反应的化学方程式。33. 用下图实验证明无明显现象反应的发生。
(1)、1-3中有明显现象的是(填序号)。(2)、4中的现象为。(3)、孔穴5中测得反应后溶液的为2,则反应后溶液中的溶质有。(4)、6中加入的X与盐酸发生置换反应,选择X并写出反应的化学方程式。33. 用下图实验证明无明显现象反应的发生。实验1,已知:通常情况下,1体积的水约能溶解1体积的。
实验1
 实验2
实验2  (1)、实验1,为证明与发生反应,观察到乙中气球变鼓的程度小于甲。集气瓶乙里应加入。(2)、写出与发生反应的化学方程式。(3)、实验2,观察到溶液由红色变为无色,从物质性质的角度解释产生上述现象的原因。34. 实验小组研究几种常用胃药的抗酸效果。
(1)、实验1,为证明与发生反应,观察到乙中气球变鼓的程度小于甲。集气瓶乙里应加入。(2)、写出与发生反应的化学方程式。(3)、实验2,观察到溶液由红色变为无色,从物质性质的角度解释产生上述现象的原因。34. 实验小组研究几种常用胃药的抗酸效果。【查阅资料】
i.溶液的pH越大,酸性越弱。人体胃液的主要成分为盐酸,正常范围为0.9~1.5。
ⅱ.三种胃药的有效成分如下。胃药使用不当,可能导致胃胀气等症状。
胃药a
胃药b
胃药c
碳酸氢钠
铝碳酸镁
氢氧化铝
【进行实验】
实验一:验证胃药是否能抗酸
各取的稀盐酸放入三个小烧杯中,分别加入有效成分质量相同的三种胃药,搅拌 , 观察实验现象并用传感器测定反应后。
现象
反应后
胃药a
产生大量气泡
6.37
胃药b
产生极少量气泡
4.25
胃药c
无气泡
1.34
(1)、胃药a和胃药b产生的气体均为 , 实验室检验该气体的试剂是。(2)、胃药c中的氢氧化铝与盐酸发生中和反应,其化学方程式为。(3)、由实验一可知三种胃药都能抗酸,依据是。(4)、实验二:探究影响胃药抗酸效果的因素下表所示实验中,均取的稀盐酸,加入胃药,搅拌,用传感器测定一定反应时间的反应后(反应后越大,抗酸效果越好)。
实验编号
胃药种类
有效成分质量/g
反应时间/s
反应后
①
胃药a
0.5
60
6.02
②
胃药a
0.5
120
6.37
③
胃药a
0.5
180
6.54
④
胃药b
0.5
60
3.93
⑤
胃药b
0.5
120
4.25
⑥
胃药b
0.5
180
4.70
⑦
胃药c
0.5
60
1.26
⑧
胃药c
0.5
120
1.34
⑨
胃药c
0.5
180
1.42
探究反应时间对胃药抗酸效果的影响的实验组合是(填序号,任写一个组合)。
(5)、由实验二可知,胃药种类对抗酸效果的影响的结论是。(6)、【反思与评价】实际应用中,胃药b比胃药a、c使用得更多。结合上述实验,说明胃药b具有的优势是。
35. 氮化镁()是制造特殊陶瓷的原料,可用镁条在氮气中燃烧获得,其主要反应为 , 若制得100kg氮化镁,计算参加反应的镁的质量(写出计算过程及结果)。