福建省龙岩市长汀县2024年中考化学一模试题
试卷更新日期:2024-05-14 类型:中考模拟
一、第Ⅰ卷共10题,每题3分,共30分。在每小题给出的四个选项中,只有一个选项符合题目要求。
-
1. “绿水青山就是金山银山”,已成为国家意志和全民共识,建设天蓝、地绿水清的美丽中国我们任重而道远。下列做法与我国绿色发展理念不相符的是( )A、私挖滥采 B、降低能耗 C、低碳出行 D、保护生态2. 天宫课堂播种科学梦想。下列天宫课堂的实验中,涉及化学变化的是A、球形火焰 B、陀螺旋转 C、拍击水球 D、钢球碰撞3. 规范的实验操作是基本的化学实验技能。下列操作正确的是( )A、闻气体气味
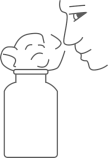 B、二氧化碳验满
B、二氧化碳验满 C、稀释浓硫酸
C、稀释浓硫酸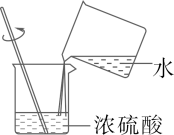 D、检查装置气密性
D、检查装置气密性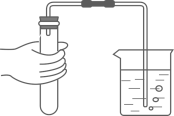 4. 科学家将微小的固态氢置于488万个大气压下,使固体中所有的氢气分子破裂为氢原子,制得具有金属性质的金属氢。下列说法正确的是( )A、金属氢是由氢分子构成的 B、金属氢与氢气的化学性质相同 C、金属氢能导电 D、金属氢形成过程中原子核发生改变5. “加铁酱油”“高锌奶粉”“富硒茶叶”中,“铁、锌、硒”指的是( )A、单质 B、元素 C、金属 D、维生素6. 下列关于燃烧、灭火和自救的说法正确的是( )A、电器着火,立即用水来灭火 B、发生火灾时,打开所有门窗,有利于逃生 C、用灯帽盖灭酒精灯的灭火原理是隔绝氧气 D、炉火越吹越旺是因为吹气降低了木柴的着火点7. 氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法正确的是( )
4. 科学家将微小的固态氢置于488万个大气压下,使固体中所有的氢气分子破裂为氢原子,制得具有金属性质的金属氢。下列说法正确的是( )A、金属氢是由氢分子构成的 B、金属氢与氢气的化学性质相同 C、金属氢能导电 D、金属氢形成过程中原子核发生改变5. “加铁酱油”“高锌奶粉”“富硒茶叶”中,“铁、锌、硒”指的是( )A、单质 B、元素 C、金属 D、维生素6. 下列关于燃烧、灭火和自救的说法正确的是( )A、电器着火,立即用水来灭火 B、发生火灾时,打开所有门窗,有利于逃生 C、用灯帽盖灭酒精灯的灭火原理是隔绝氧气 D、炉火越吹越旺是因为吹气降低了木柴的着火点7. 氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法正确的是( ) A、硝酸钾的溶解度大于氯化钠的溶解度 B、将20℃的氯化钠饱和溶液升温至40℃,溶液的溶质质量分数不变(忽略水分蒸发) C、常用冷却结晶的方法从氯化钠溶液中获得其晶体 D、40℃时,将63.9g硝酸钾晶体放入100g水中,充分搅拌后,所得溶液的溶质质量分数为63.9%8. 硫辛酸(C8H14O2S2)被称为“万能抗氧化剂”,广泛用于治疗和预防心脏病等多种疾病。下列有关硫辛酸的说法错误的是( )A、属于有机化合物 B、碳元素质量分数最大 C、由4种元素组成 D、含有1个氧分子9. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化如下图所示。下列说法正确的是( )
A、硝酸钾的溶解度大于氯化钠的溶解度 B、将20℃的氯化钠饱和溶液升温至40℃,溶液的溶质质量分数不变(忽略水分蒸发) C、常用冷却结晶的方法从氯化钠溶液中获得其晶体 D、40℃时,将63.9g硝酸钾晶体放入100g水中,充分搅拌后,所得溶液的溶质质量分数为63.9%8. 硫辛酸(C8H14O2S2)被称为“万能抗氧化剂”,广泛用于治疗和预防心脏病等多种疾病。下列有关硫辛酸的说法错误的是( )A、属于有机化合物 B、碳元素质量分数最大 C、由4种元素组成 D、含有1个氧分子9. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化如下图所示。下列说法正确的是( ) A、图中c点所示溶液呈碱性 B、由a点到b点的pH变化过程证明酸和碱发生了中和反应 C、图中a点所示溶液中,含有的溶质是和 D、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中10. 某化学兴趣小组将二氧化硫通入水中模拟酸雨的形成。待pH稳定在3.73左右,向装置中通入氧气,待pH稳定在3.67左右,向装置中注入过氧化氢溶液,实验中pH随时间的变化如图所示。下列说法错误的是( )
A、图中c点所示溶液呈碱性 B、由a点到b点的pH变化过程证明酸和碱发生了中和反应 C、图中a点所示溶液中,含有的溶质是和 D、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中10. 某化学兴趣小组将二氧化硫通入水中模拟酸雨的形成。待pH稳定在3.73左右,向装置中通入氧气,待pH稳定在3.67左右,向装置中注入过氧化氢溶液,实验中pH随时间的变化如图所示。下列说法错误的是( ) A、通入二氧化硫前,水的pH值略小于7,可能是因为空气中的二氧化碳与水反应 B、注入过氧化氢溶液后,溶液的酸性增强 C、通入氧气和注入过氧化氢溶液相比较,前者pH变化更明显 D、二氧化硫的排放易导致硫酸型酸雨,因此煤应脱硫处理
A、通入二氧化硫前,水的pH值略小于7,可能是因为空气中的二氧化碳与水反应 B、注入过氧化氢溶液后,溶液的酸性增强 C、通入氧气和注入过氧化氢溶液相比较,前者pH变化更明显 D、二氧化硫的排放易导致硫酸型酸雨,因此煤应脱硫处理二、共8题,共70分
-
11. 化学与人类的生产生活密切相关。(1)、《易经》——“泽中有火……上火下泽”,描述的是沼气燃烧现象。写出沼气的主。要成分甲烷完全燃烧的化学方程式:。(2)、工业制铷的原理为: , 则物质X的化学式为。(3)、银锌纽扣电池是利用锌粉与氧化银发生置换反应,该反应的化学方程式是。12. 锌溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。(1)、已知锌在元素周期表中的部分信息和溴原子结构示意图如图所示,锌的相对原子质量为 , 溴原子的质子数为 , 溴原子得到电子形成离子,其符号为。
 (2)、锌溴液流电池电极材料中含有氮化钛(TiN),已知氮化钛中氮元素显-3价,则氮化钛中钛元素的化合价为。(3)、氢溴酸(HBr)与盐酸的化学性质相似,请写出氢溴酸和锌反应的化学方程式:。13. 实验小组结合物理学科的杠杆原理和部分物质的性质完成下面两个实验。
(2)、锌溴液流电池电极材料中含有氮化钛(TiN),已知氮化钛中氮元素显-3价,则氮化钛中钛元素的化合价为。(3)、氢溴酸(HBr)与盐酸的化学性质相似,请写出氢溴酸和锌反应的化学方程式:。13. 实验小组结合物理学科的杠杆原理和部分物质的性质完成下面两个实验。 (1)、实验1:加热铜丝团一段时间后可以观察到铜丝团变成色,同时杠杆左端(填“上升”或“下沉”)。(2)、实验2:一段时间后铁粉包下沉的原因是。将集气瓶中的水换成下列(填标号)并将铁粉包浸泡一段时间后取出晾干,杠杆也会出现相似现象,请用化学方程式解释。
(1)、实验1:加热铜丝团一段时间后可以观察到铜丝团变成色,同时杠杆左端(填“上升”或“下沉”)。(2)、实验2:一段时间后铁粉包下沉的原因是。将集气瓶中的水换成下列(填标号)并将铁粉包浸泡一段时间后取出晾干,杠杆也会出现相似现象,请用化学方程式解释。A.稀硫酸 B.硫酸铜溶液 C.氯化镁
14. 甲和乙反应生成丙和丁的微观示意图如图。 (1)、其中属于属于单质的是(选填甲、乙、丙、丁)。(2)、甲为甲醇,甲醇的化学式为 , 请写出上述反应的化学方程式。(3)、一辆普通家用轿车一百公里消耗汽油8L。相同排量汽车的燃料换成甲醇后,一百公里消耗12L甲醇,若甲醇燃料密度约为 , 请你计算每一百公里使用的甲醇燃料中所含碳元素的质量为(请保留小数点后一位)。15. 《天工开物》中记载“浇水转釉”的操作如图,其原理是:焙烧工作完成时,封闭窑门并从窑顶慢慢浇水,高温下碳和水蒸气反应生成氢气和一氧化碳。
(1)、其中属于属于单质的是(选填甲、乙、丙、丁)。(2)、甲为甲醇,甲醇的化学式为 , 请写出上述反应的化学方程式。(3)、一辆普通家用轿车一百公里消耗汽油8L。相同排量汽车的燃料换成甲醇后,一百公里消耗12L甲醇,若甲醇燃料密度约为 , 请你计算每一百公里使用的甲醇燃料中所含碳元素的质量为(请保留小数点后一位)。15. 《天工开物》中记载“浇水转釉”的操作如图,其原理是:焙烧工作完成时,封闭窑门并从窑顶慢慢浇水,高温下碳和水蒸气反应生成氢气和一氧化碳。 (1)、高温下,碳和水蒸气的反应属于(填基本反应类型)。(2)、“浇水转釉”时转化成FeO和 , 中铁元素有两种化合价,其化学式也可表示为“”,则X的化学式为。(3)、现代工业利用一氧化碳冶炼赤铁矿(主要含)的化学方程式为。16. 3%的硼酸溶液可用于清洗皮肤的小面积创伤。现要配制300g质量分数为3%的硼酸溶液,实验操作如下:(1)、称量硼酸固体的质量:在下图中分别标出所选砝码的质量和游码的示数。
(1)、高温下,碳和水蒸气的反应属于(填基本反应类型)。(2)、“浇水转釉”时转化成FeO和 , 中铁元素有两种化合价,其化学式也可表示为“”,则X的化学式为。(3)、现代工业利用一氧化碳冶炼赤铁矿(主要含)的化学方程式为。16. 3%的硼酸溶液可用于清洗皮肤的小面积创伤。现要配制300g质量分数为3%的硼酸溶液,实验操作如下:(1)、称量硼酸固体的质量:在下图中分别标出所选砝码的质量和游码的示数。 (2)、量取:用量筒量取mL水 .(3)、溶解:用到的玻璃仪器是烧杯和。(4)、装瓶、贴标签:在图中的标签中填上相应的内容。(5)、如果装瓶时有部分硼酸溶液洒出,则剩余溶液的溶质质量分数(填“变大”“变小”或“不变”)。
(2)、量取:用量筒量取mL水 .(3)、溶解:用到的玻璃仪器是烧杯和。(4)、装瓶、贴标签:在图中的标签中填上相应的内容。(5)、如果装瓶时有部分硼酸溶液洒出,则剩余溶液的溶质质量分数(填“变大”“变小”或“不变”)。 17. 欲证明“与NaOH发生了化学反应”,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去)。
17. 欲证明“与NaOH发生了化学反应”,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去)。实验1:按图1所示装置进行实验。

实验前U型管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U型管中的液面左高右低。据此,甲同学得出“与NaOH发生了化学反应”的结论。
(1)、U型管中液面高度发生变化的原因是。(2)、上述结论的证据不充足,理由是。(3)、实验2:按图2所示装置进行实验。
查阅资料:ⅰ.溶液呈中性;ⅱ.
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭 , 将注射器中的溶液缓缓推入A中;
③中物质充分作用后,打开中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;
④关闭 , 打开 , 将注射器活塞向上拉,中溶液倒吸入中。
步骤③“产生沉淀”的现象仍不足以证明与发生了化学反应,理由是。
(4)、步骤④中,若观察到(填现象),证明与NaOH发生了化学反应。与NaOH反应的化学方程式为。18. 我国科学家发明了消除甲醛(HCHO)污染同时制取H2O2的绿色方法,若要消除30g甲醛,理论上可获得H2O2质量为多少?(已知:。写出根据化学方程式计算的过程)