重庆市荣昌名校2023-2024学年高三下学期化学开学考试试题
试卷更新日期:2024-05-11 类型:开学考试
一、单选题(每题3分,共42分)
-
1. 中国古代诗词和书籍中蕴含着化学知识。下列说法错误的是( )A、“白玉金边素瓷胎,雕龙描凤巧安排”,瓷器是人类较早应用的人造硅酸盐材料 B、“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”含有胶体 C、“九秋风露越窑开,夺得千峰翠色来”,“翠色”来自氧化亚铜 D、镀金时“以汞和金涂银器上,入火则汞去,而金存”,其中“入火则汞去”指汞的挥发2. 设为阿伏加德罗常数的值,下列说法正确的是( )A、配合物的熔点为 , 沸点为103℃,键的数目为 B、醋酸溶液中溶解醋酸钠固体后,醋酸根离子数目不可能为 C、铅蓄电池充电时,当正极增加9.6g时,转移的电子数 D、标准状况下,和在光照下充分反应后分子数为3. 利用如图装置和试剂进行实验(部分夹持装置略),能达到相应实验目的的是( )
A
B
C
D




制备并收集少量 NO2
吸收尾气 Cl2
配制 NaCl溶液
制备Fe(OH)2
A、A B、B C、C D、D4. 下列除杂试剂选用正确且除杂过程涉及氧化还原反应的是选项
物质(括号内为杂质)
除杂试剂
A
蒸馏水、碱石灰
B
盐酸、溶液、二氧化碳
C
溶液、溶液、盐酸
D

酸性溶液
A、A B、B C、C D、D5. 实现中国梦,离不开化学与科技的发展,下列有关说法错误的是A、我国“天眼”的球面射电板上使用的铝合金板属于金属材料 B、华为公司自主研发的“麒麟9000”芯片的主要成分是单质硅 C、新能源汽车电池使用的石墨烯电极材料属于有机高分子化合物 D、“神舟十四号”宇宙飞船返回舱表层材料中的玻璃纤维属于无机非金属材料6. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z为原子序数依次增大的五种短周期主族非金属元素,Z是地壳中含量最多的元素。下列说法正确的是( ) A、基态原子的第一电离能:W<X<Y<Z B、基态原子未成对电子数:W<X<Z<Y C、1 mol该化合物中含有配位键的数目为 D、W基态原子的电子的空间运动状态有5种7. 我国科学家合成了检测的荧光探针A,其结构简式如图。
A、基态原子的第一电离能:W<X<Y<Z B、基态原子未成对电子数:W<X<Z<Y C、1 mol该化合物中含有配位键的数目为 D、W基态原子的电子的空间运动状态有5种7. 我国科学家合成了检测的荧光探针A,其结构简式如图。
下列关于荧光探针A分子的说法不正确的是( )
A、能发生消去反应 B、能形成分子内氢键 C、能与饱和溴水发生取代反应和加成反应 D、1mol探针A最多能与4molNaOH反应8. 实验室模拟氨催化氧化法的实验装置如图所示。下列说法错误的是( )
已知:装置③中收集到了红棕色气体。
A、装置①中可以盛装碱石灰 B、氨催化氧化可直接生成NO2 C、装置④中溶液可能会变红 D、装置⑤的作用是处理尾气,气体X的主要成分为N29. 下列反应的离子方程式正确的是( )A、红热的木炭与浓硝酸反应: B、过量氯气通入溴化亚铁溶液中 C、硫氰化铁溶液中加NaOH溶液产生沉淀: D、向明矾溶液中加溶液至沉淀质量最大:10. 由下列实验现象一定能得出相应结论的是( )选项
A
B
C
D
装置图




现象
左边棉球变棕黄色,右边棉球变蓝色
试管中先出现淡黄色固体,后出现黄色固体
试管中液体变浑浊
右边试管产生气泡较快
结论
氧化性:
溶解度:AgCl>AgBr>AgI
非金属性:C>Si
催化活性:
A、A B、B C、C D、D11. NOx是主要大气污染物,利用反应消除NO2污染的电化学装置如图所示。下列说法错误的是( ) A、外电路的电子方向为a→负载→b B、b极的电极反应为: C、若离子交换膜为阴离子交换膜,则左池NaOH溶液浓度将增大 D、电路中转移4mol电子时理论上可消除标准状况下1molNO2的污染12. 工业上利用碳热还原制得。进而生产各种含钡化合物,温度对反应后组分的影响如图。
A、外电路的电子方向为a→负载→b B、b极的电极反应为: C、若离子交换膜为阴离子交换膜,则左池NaOH溶液浓度将增大 D、电路中转移4mol电子时理论上可消除标准状况下1molNO2的污染12. 工业上利用碳热还原制得。进而生产各种含钡化合物,温度对反应后组分的影响如图。
已知:碳热还原过程中可能发生下列反应。
i.
ii.
iii.
下列关于碳热还原过程的说法正确的是( )
A、 B、400℃后,反应后组分的变化是由的移动导致的 C、温度升高,的平衡常数K减小 D、反应过程中,生成的和的物质的量之和始终等于投入C的物质的量13. 三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,氯气与单质碘需在温度稍低于70℃下反应制备ICl3 , 实验室制备如图所示。下列说法正确的是( ) A、装置A可选用的药品为高锰酸钾与浓盐酸 B、装置B的作用是除杂,也作安全瓶,在本实验中可以和装置C互换位置 C、装置C中的硅胶可用浓硫酸代替 D、装置D最恰当的加热方式是用酒精灯先预热再集中加热14. 某同学在两个相同的特制容器中分别加入20mL 0.4mol·L-1Na2CO3溶液和40mL 0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压强传感器检测,所得曲线如图。下列说法错误的是( )
A、装置A可选用的药品为高锰酸钾与浓盐酸 B、装置B的作用是除杂,也作安全瓶,在本实验中可以和装置C互换位置 C、装置C中的硅胶可用浓硫酸代替 D、装置D最恰当的加热方式是用酒精灯先预热再集中加热14. 某同学在两个相同的特制容器中分别加入20mL 0.4mol·L-1Na2CO3溶液和40mL 0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压强传感器检测,所得曲线如图。下列说法错误的是( )
已知:常温下,酚酞的变色范围是pH 8.2~10.0,甲基橙的变色范围是pH 3.1~4.4。
A、曲线甲表示向Na2CO3溶液中滴加盐酸 B、在b点无气体产生,此处发生反应的离子方程式为 C、Na2CO3溶液或NaHCO3溶液中均有 D、滴定分析时,a点可用酚酞、c点可用甲基橙作指示剂指示滴定终点二、填空题(共58分)
-
15. “刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分Ca5(PO4)3F,还有Fe2O3、CaCO3等杂质)为原料生产白磷(P4)同时制得刀片电池正极材料FePO4的工艺流程:
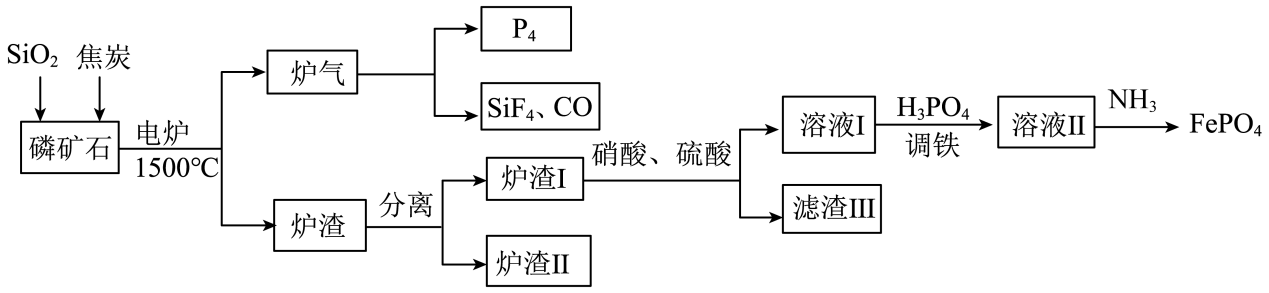
已知:①FePO4可溶于pH<2的酸性溶液。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)、白磷(P4)不溶于水但易溶于二硫化碳,说明P4是(填“极性分子”或“非极性分子”)。(2)、炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:。(3)、炉渣Ⅱ的主要成分是。(4)、“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是。若此条件下Fe3+恰好完全转化为FePO4沉淀(当溶液中某离子浓度≤1×10−5mol/L时,可视为该离子沉淀完全),过滤,现往滤液中加入2mol/L的MgCl2溶液(设溶液体积增加1倍),此时溶液中Mg3(PO4)2沉淀生成(填“有”或“无”或“无法确定”)【已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10−22、1.0×10−24】(5)、储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示: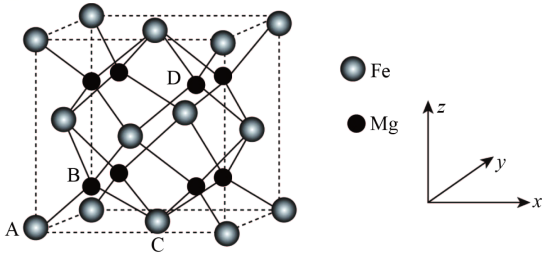
其中A的原子坐标参数为(0,0,0), B为( , , ),C为( , , 0),则D点的坐标参数为。此晶胞中Fe的配位数是。
16. 深入研究碳、氮元素的物质转化有着重要的实际意义, 按要求回答下列问题:(1)、合成尿素的反应为: 2NH3(g)+CO2(g)CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2 , 发生上述反应。下列叙述不能说明反应已经达到平衡状态的是____(填标号)。A、2v正(NH3) = v逆[CO(NH2)2] B、压强不再变化 C、混合气体的密度不再变化 D、CO2的体积分数不再变化(2)、CO用于处理大气污染物N2O的反应为CO(g)+N2O(g)CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH=kJ·mol-1;该总反应的决速步是反应(填“①”或“②”)
(3)、已知:CO(g)+N2O(g) CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是____(填字母序号)。A、升温 B、恒容时,再充入CO C、恒容时,再充入N2O D、恒压时,再充入N2(4)、在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和 N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与、在=1时N2O的转化率与的变化曲线如图3所示:
①表示N2O的转化率随的变化曲线为曲线(填“I”或“Ⅱ”);
②T1T2(填“>”或“<”);
③已知:该反应的标准平衡常数 , 其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=(列出计算式)。
17. 硫氰化钾()俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
已知:①不溶于水,密度比水的大;
②不溶于;
③三颈烧瓶内盛放有、水和催化剂。
回答下列问题:
(1)、制备溶液:①实验前,经检验装置的气密性良好。其中装置B中的试剂是。
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应该反应比较缓慢),当看到现象时说明该反应接近完全。
(2)、制备溶液:①熄灭A处的酒精灯,关闭 , 移开水浴,将装置D继续加热至105℃,当完全分解后(),打开 , 继续保持液温105℃,缓缓滴入适量的溶液,发生反应的化学方程式为。
②装置E中多孔球泡的作用是。
(3)、制备晶体:先滤去三颈烧瓶中的固体催化剂,、、过滤、洗涤、干燥,得到硫氰化钾晶体。(4)、测定晶体中的含量:称取10.0g样品,配成溶液。量取溶液于锥形瓶中,加入适量稀硝酸,再加入几滴溶液作指示剂,用标准溶液滴定,达到滴定终点时消耗标准溶液。①滴定时发生的反应:(白色)。则判断到达滴定终点的方法是。
②晶体中的质量分数为(结果精确至0.1%)。
18. 化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如图: (1)、A中含有官能团的名称为。(2)、B→C的反应类型为。(3)、写出C→D的化学反应方程式:。(4)、满足下列条件的C的同分异构体有种。
(1)、A中含有官能团的名称为。(2)、B→C的反应类型为。(3)、写出C→D的化学反应方程式:。(4)、满足下列条件的C的同分异构体有种。①含有苯环,苯环上有三个取代基,其中氨基只与苯环直接相连;
②与氯化铁溶液反应显紫色,与NaHCO3溶液反应有气体产生。
(5)、写出同时满足下列条件的C的一种同分异构体的结构简式:。①含有苯环,且分子中有一个手性碳原子;
②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(6)、G的分子式为 , 经氧化得到H,写出G的结构简式:。(7)、已知: (R代表烃基,R'代表烃基或H)。请写出以
(R代表烃基,R'代表烃基或H)。请写出以 、
、 和为原料制备
和为原料制备 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。