重庆市乌江新高考协作体2023-2024学年高一下学期化学开学考试试题
试卷更新日期:2024-05-11 类型:开学考试
一、单选题
-
1. 下列属于电离方程式且书写正确的一项是( )A、+H2O⇌H2CO3+OH- B、H2CO3⇌2H++ C、CH3COOH+OH-⇌CH3COO-+H2O D、CH3COOH⇌CH3COO-+H+2. 硫铁矿主要成分是二硫化亚铁(FeS2)是一种重要的化工原料,常用来制备铁、硫酸,其中硫元素的化合价为( )A、0 B、-1 C、+1 D、+23. 下列物质的电子式书写正确的是( )A、Cl:Cl B、
 C、
C、 D、
D、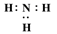 4. 下列物质的分类正确的是( )
4. 下列物质的分类正确的是( )选项
碱性氧化物
酸性氧化物
碱
酸
盐
A
B
C
D
CO
A、A B、B C、C D、D5. 已知氯气和溶液在一温度下能发生化学反应,其方程式为: , 。某温度下,将氯气通入溶液中,反应得到、和的混合溶液,经测定与的个数比为3:1,则氯气与氢氧化钠反应时,被氧化的氯原子和被还原的氯原子的个数比为( )A、21:5 B、1:2 C、3:1 D、2:16. 下列有关分散系的叙述不正确的是( )A、可利用丁达尔效应区分FeCl3溶液和Fe(OH)3胶体 B、将饱和FeCl3溶液滴加到煮沸的NaOH溶液中可制得Fe(OH)3胶体 C、胶体区别于其他分散质粒子的本质特征是分散质粒子直径大小在1~100nm之间 D、“朝坛雾卷,曙岭烟沉”,雾有丁达尔现象是因为胶体粒子对光有散射作用7. 下列各组离子一定能大量共存的是 ( )A、加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl- B、含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl- C、c(H+)/c(OH-)=1×10-10的溶液中:NH4+、K+、Ca2+、Cl- D、水电离的c(H+)=1×10-12mol·L-1的溶液中:Na+、K+、HCO3-、Cl-8. 某同学将金属钠露置于空气中足够长时间,观察到下列现象:银白色→变灰暗→变白色→出现液滴→白色固体→白色粉末。下列有关叙述不正确的是( )A、表面迅速变暗是因为钠与空气中的氧气反应生成了Na2O B、出现液滴原因是生成的Na2CO3吸收空气中的水蒸气在表面形成了溶液 C、最后白色粉末为碳酸钠粉末 D、最后白色粉末的质量比金属钠质量大9. 如图是甲、乙的溶解度曲线。下列说法不正确的是( ) A、t1℃时,乙的溶解度大于甲的溶解度 B、t2℃时,甲、乙饱和溶液中溶质的质量分数相等 C、降低温度能使接近饱和的甲溶液变为饱和溶液 D、t3℃时,75g甲的饱和溶液中加入50g水,可以得到质量分数为25%的溶液10. 氯气可用于杀菌和消毒,这是因为( )A、氯气有毒,可毒死病菌 B、氯气具有漂白作用 C、氯气与水反应生成具有强氧化性的HClO D、氯气与水反应生成的盐酸是强酸11. 下列反应的离子方程式书写正确的是( )A、稀硫酸滴在CuO中: B、稀硫酸与Ba(OH)2溶液混合: C、稀硝酸滴在大理石上: D、实验室制取Fe(OH)3胶体:12. 向500含、、的溶液中缓慢通入L(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是( )
A、t1℃时,乙的溶解度大于甲的溶解度 B、t2℃时,甲、乙饱和溶液中溶质的质量分数相等 C、降低温度能使接近饱和的甲溶液变为饱和溶液 D、t3℃时,75g甲的饱和溶液中加入50g水,可以得到质量分数为25%的溶液10. 氯气可用于杀菌和消毒,这是因为( )A、氯气有毒,可毒死病菌 B、氯气具有漂白作用 C、氯气与水反应生成具有强氧化性的HClO D、氯气与水反应生成的盐酸是强酸11. 下列反应的离子方程式书写正确的是( )A、稀硫酸滴在CuO中: B、稀硫酸与Ba(OH)2溶液混合: C、稀硝酸滴在大理石上: D、实验室制取Fe(OH)3胶体:12. 向500含、、的溶液中缓慢通入L(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是( ) A、 B、时反应为 C、原溶液中 D、时总反应为13. 研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH 溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )
A、 B、时反应为 C、原溶液中 D、时总反应为13. 研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH 溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( ) A、O处溶液中的阳离子为:H+、Fe2+、Fe3+、Al3+ B、DE段反应的离子方程式为:NH4++OH-=NH3·H2O C、合金中,n(Al)=0.008mol D、欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量14. 下表列出了前20号元素中的某些元素性质的有关数据
A、O处溶液中的阳离子为:H+、Fe2+、Fe3+、Al3+ B、DE段反应的离子方程式为:NH4++OH-=NH3·H2O C、合金中,n(Al)=0.008mol D、欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量14. 下表列出了前20号元素中的某些元素性质的有关数据元素标号
元素性质
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
原子半径
(10-10m)
1.52
2.27
0.74
1.43
0.77
1.10
0.99
1.86
0.75
0.71
最高价态
+1
+1
—
+3
+4
+5
+7
+1
+5
—
最低价态
—
—
-2
—
-4
-3
-1
—
-3
-1
元素R的原子半径为1.02×10-10 m,下列有关叙述正确的是( )
A、以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ B、由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 C、元素R在周期表中位于第三周期第ⅤI族 D、若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式
二、非选择题
-
15. 高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2 , 还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:还原焙烧主反应为2MnO2+C2MnO+CO2↑。
可能用到的数据如下:
氢氧化物
Fe(OH)3
Fe(OH)2
Cu(OH)2
Mn(OH)2
开始沉淀pH
1.5
6.5
4.2
8.1
沉淀完全pH
3.7
9.7
7.4
10.1
根据要求回答下列问题:
(1)、在实验室进行步骤A,混合物应放在中加热;步骤C中的滤渣为。(2)、步骤D中氧化剂与还原剂的物质的量之比为。(3)、步骤E中调节pH的范围为 , 其目的是。(4)、步骤G,温度控制在35℃以下的原因是 , 若Mn2+恰好沉淀完全时测得溶液中的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=。(5)、生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是。(6)、现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中完全转化为);加入稍过量的硫酸铵,发生反应+=N2↑+2H2O以除去;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。①酸性K2Cr2O7溶液与Fe2+反应的离子方程为。
②试样中锰元素的质量分数为。
16. 高铁酸钾是一种易溶于水,高效的多功能水处理剂。工业上通常先制得高铁酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从而使高铁酸钾析出。(1)、高铁酸钾中铁元素的化合价为 , 推测其具有的化学性质是。(2)、高铁酸钾与水反应生成、(胶体)和KOH。①该反应的离子方程式为。
②高铁酸钾作为水处理剂起到的作用是。
(3)、在无水条件下制备高铁酸钠的主要反应为。①该反应中的氧化剂为 , 氧化产物为。
②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是。
③在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:。
17. (一)如图是部分短周期主族元素的原子序数与其最高或最低化合价的关系图(用原子序数代表所对应的元素),已知a为元素周期表中相对原子质量最小的元素,请回答下列问题: (1)、a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式 , 乙分子类型属于分子(填“极性”或“非极性”)。(2)、b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为 , 如果一次性取样分别检验上述反应的生成物,按照最简单的操作顺序写出所用试剂的名称。(3)、f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为 , f元素的两种盐溶液也可以反应得到f元素最高价氧化物对应的水化物,该反应的离子方程式为。(4)、(二)过渡金属在社会生产、生活发展中具有重要作用。
(1)、a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式 , 乙分子类型属于分子(填“极性”或“非极性”)。(2)、b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为 , 如果一次性取样分别检验上述反应的生成物,按照最简单的操作顺序写出所用试剂的名称。(3)、f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为 , f元素的两种盐溶液也可以反应得到f元素最高价氧化物对应的水化物,该反应的离子方程式为。(4)、(二)过渡金属在社会生产、生活发展中具有重要作用。原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置 , 其价电子排布图为。
 (5)、铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为。若该晶体的密度是ρg•cm-3 , 则两个最近的Fe原子间的距离为cm。(用NA表示阿伏加德罗常数的值)(6)、铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2 , 其中Htrz为1,2,4—三氮唑( )
(5)、铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为。若该晶体的密度是ρg•cm-3 , 则两个最近的Fe原子间的距离为cm。(用NA表示阿伏加德罗常数的值)(6)、铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2 , 其中Htrz为1,2,4—三氮唑( ) 。
。①配合物中阴离子的空间构型为 , 中心原子的杂化方式是。
②
 分子中含σ键与π键个数比为。
分子中含σ键与π键个数比为。③1摩尔1,2,4—三氮唑最多能与molH+结合。
18. 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)、该小组利用右图装置及试剂制备并收集适量Cl2 , 装置B、C的作用分别是、。(2)、制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有(写出全部微粒)。(3)、饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。①滤液漂白性增强的原因是(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HClO的方程式是。
(4)、Ⅱ.ClO3-、Cl-和H+反应的探究KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号
1
2
3
4
氯酸钾饱和溶液
1mL
1mL
1mL
1mL
氯化钾固体
1g
1g
1g
1g
水
8mL
6mL
3mL
0mL
硫酸(6mol/L)
0mL
2mL
( )mL
8mL
现象
无现象
溶液呈浅黄色
溶液呈黄绿色,生成浅黄绿色气体
溶液呈黄绿色,
生成黄绿色气体
①该系列实验的目的。
②烧杯3取用硫酸的体积应为mL。
(5)、该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2。