湖北省圆创联盟2024年3月高考化学联合测评(一模)试卷
试卷更新日期:2024-05-11 类型:高考模拟
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 湖北盐业历史悠久,早在唐代已有零星的产盐记载。下列说法错误的是( )A、既可做调味品也可做防腐剂 B、焰色试验可用于区分和 C、电解食盐水的产物可用于生产漂粉精 D、医疗上生理盐水是含0.9%的溶液2. 下列化学用语表示正确的是( )A、键的电子云形状:
 B、固体HF中的链状结构:
B、固体HF中的链状结构: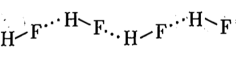 C、二聚中的杂化方式:
D、石墨的层状结构:
C、二聚中的杂化方式:
D、石墨的层状结构: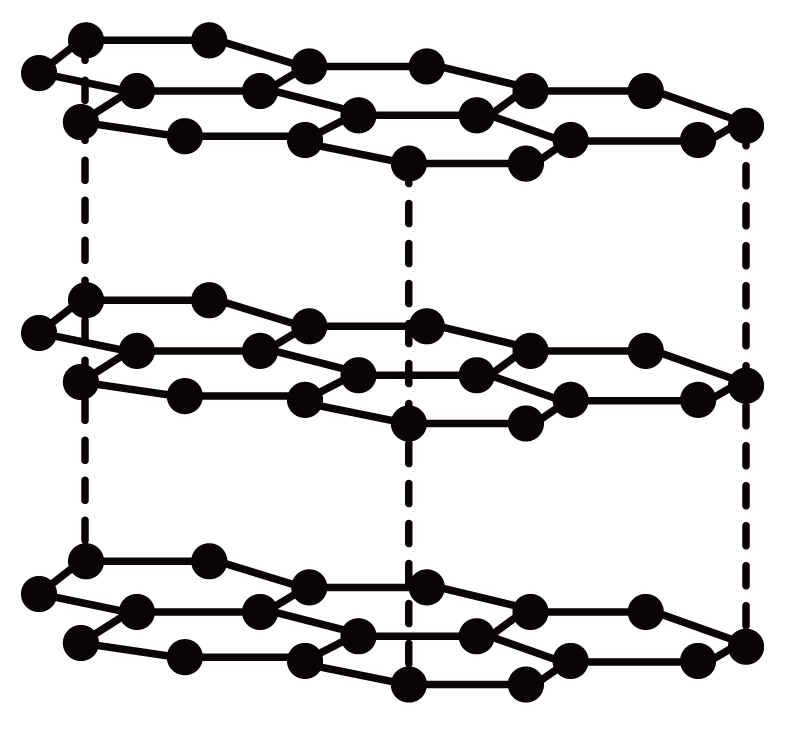 3. 生活中处处有化学,下列说法错误的是( )A、医药、农药、食品添加剂属于精细化学品 B、自然界存在的多糖甲壳质是不可再生资源 C、压电陶瓷能实现机械能与电能的相互转化 D、高分子分离膜已广泛应用于饮用水的制取4. 蕲艾是十大楚药之一,所含精油有很好的抗虫作用,其有效成分之一的结构简式如下图所示。下列说法错误的是( )
3. 生活中处处有化学,下列说法错误的是( )A、医药、农药、食品添加剂属于精细化学品 B、自然界存在的多糖甲壳质是不可再生资源 C、压电陶瓷能实现机械能与电能的相互转化 D、高分子分离膜已广泛应用于饮用水的制取4. 蕲艾是十大楚药之一,所含精油有很好的抗虫作用,其有效成分之一的结构简式如下图所示。下列说法错误的是( ) A、存在顺反异构现象 B、有特征红外吸收峰 C、最多有21个原子共平面 D、该物质能消耗5. 溴是一种重要的基础化工原料,下列有关溴的实验装置及原理正确的是( )
A、存在顺反异构现象 B、有特征红外吸收峰 C、最多有21个原子共平面 D、该物质能消耗5. 溴是一种重要的基础化工原料,下列有关溴的实验装置及原理正确的是( )

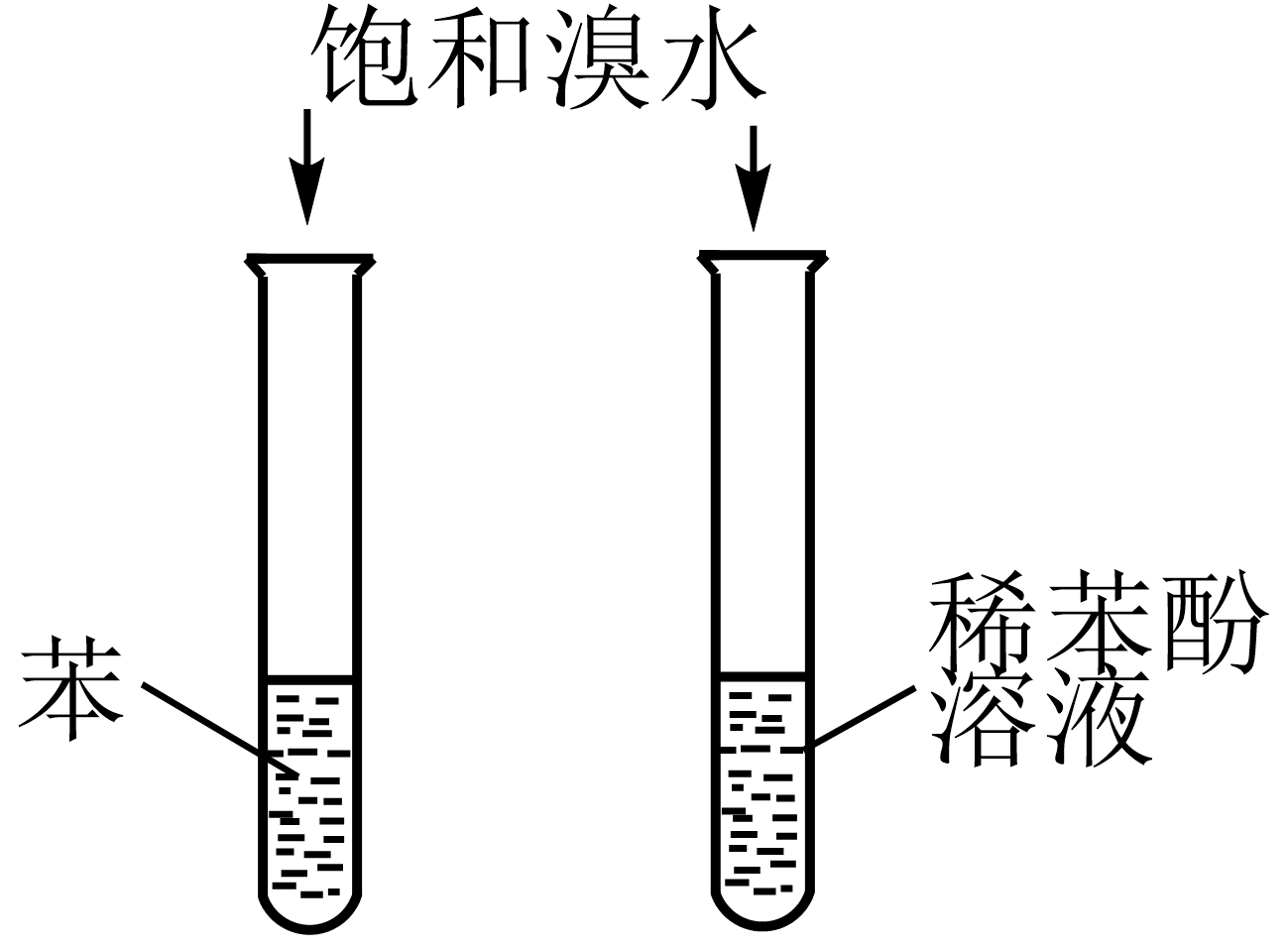

A.实验室保存液溴
B.验证二氧化硫的漂白性
C.验证苯环对羟基的活化作用
D.验证醛基的还原性
A、A B、B C、C D、D6. CaCN2可以作为固态氮肥,并改善土壤酸性,通过反应制备。下列说法错误的是( )A、该反应为熵增过程 B、该反应实现了氮的固定 C、该反应需在无水条件下进行 D、的电子式为 7. 是宇宙中最丰富的元素,位于第四周期且基态原子中有5个未成对电子,基态原子的能级与能级的电子数相等,是的等电子体,四种元素形成的配合物结构如下图所示,下列说法错误的是( )
7. 是宇宙中最丰富的元素,位于第四周期且基态原子中有5个未成对电子,基态原子的能级与能级的电子数相等,是的等电子体,四种元素形成的配合物结构如下图所示,下列说法错误的是( ) A、第一电离能: B、电负性: C、配体ZW中配位原子为Z D、Y的最高价氧化物为碱性氧化物8. 推理是一种重要的思维方法。下列推理合理的是( )
A、第一电离能: B、电负性: C、配体ZW中配位原子为Z D、Y的最高价氧化物为碱性氧化物8. 推理是一种重要的思维方法。下列推理合理的是( )已知
推论
A
电负性:F>O>H
键角:OF2>H2O
B
键能:H-Cl>H-Br
酸性:HCl>HBr
C
溶解性:MgSO4>CaSO4
溶解性:SrSO4>BaSO4
D
极性:NH3>PH3
极性:NCl3>PCl3
A、A B、B C、C D、D9. 下列方程式书写错误的是( )A、漂白粉在空气中生效: B、水解制取 C、线型酚醛树脂的制备: D、硅橡胶单体的制备:
10. 纳米催化制备甲酸钠的机理如下图所示:
D、硅橡胶单体的制备:
10. 纳米催化制备甲酸钠的机理如下图所示:
下列说法错误的是( )
A、纳米尺寸有利于加快反应速率 B、反应过程中有极性键的断裂与形成 C、反应过程中不需要持续补充 D、总反应的原子利用率为100%11. 下列实验方法或操作能达到实验目的的是( )实验目的
实验方法或操作
A.
在水溶液中存在
向的溶液中加入浓溶液,振荡试管,观察颜色变化
B.
检验中的碳碳双键
取样,加入适量酸性高锰酸钾溶液后观察是否褪色
C.
比较与
常温,测浓度均为的和溶液的
D.
比较Mg和Al的金属性强弱
向浓度均为和溶液中滴加浓氨水至过量
A、A B、B C、C D、D12. (可表示为)催化剂的催化原理如下图所示(为烃基)。
下列说法错误的是( )
A、总反应为: B、易溶于水相而难溶于有机相 C、与、之间的离子键强度要适中 D、PTC催化剂可用作相转移倠化剂13. 一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示(晶胞边长为apm,晶胞高为cpm,为阿伏加德罗常数的值)。
下列说法正确的是( )
A、该物质的化学式为 B、硼原子间最近距离为 C、的配位数为12 D、该物质的摩尔体积为14. 为了保护环境、充分利用铅资源,科学家设计了如下的-铅化合物燃料电池实现铅单质的回收。
下列有关说法错误的是( )
A、正极区溶液pH升高,负极区溶液pH降低 B、电子流向:电极b→负载→电极a C、阴极区电极反应式为 D、为了提高的回收率,离子交换膜为阴离子交换膜15. 菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同下体系中与关系如图所示(代表),已知。下列有关说法正确的是( ) A、数量级为 B、溶液时, C、时,曲线①呈上升趋势的原因是部分转化为 D、点时,体系中
A、数量级为 B、溶液时, C、时,曲线①呈上升趋势的原因是部分转化为 D、点时,体系中二、非选择题:本题共4小题,共55分。
-
16. 某制药厂的废钯催化剂含、、、、和活性炭,提取贵金属的流程如下:

已知:①铂系元素(包括Pt、Pd等六种元素)的单质均为惰性金属;
②性质较稳定,难溶于酸、碱,可溶于王水;
③、。
回答下列问题:
(1)、“焙烧”步骤的主要目的是除去活性炭,通常控制温度600℃、焙烧时间约 , 焙烧温度过高或时间过长均导致钯浸出率降低,原因是。(2)、“浸渣”的成分是少量及。(3)、“浸出”步骤中生成配合物 , 写出该反应的化学方程式。(4)、“氨化”步骤中转化为 , 反应后溶液 , 此时溶液中。(5)、“沉钯”步骤中的离子方程式为。(6)、存在两种平面结构,将其记为A和B。查得25℃时A、B在水中的溶解度分别为0.2577g、0.0366g,A具有广谱的抗癌活性,写出A的结构式(中共价键不必画出)。17. 乙酰水杨酸(俗称阿司匹林),是常用的解热镇痛药。实验室选择草酸绿色催化剂制备阿司匹林。【实验原理】
主反应:

副反应:

名词
熔点/℃
溶解性
水杨酸
157~159
溶于水和乙醇
乙酸酐
-73.1
易水解
乙酰水杨酸
135
微溶冷水,可溶热水,易溶于乙醇
【实验流程】

回答下列问题:
(1)、制备过程中采用的合适加热方式是。(2)、“加冷水”后,发生反应的化学方程式为。(3)、“操作2”中加入饱和溶液的目的是。(4)、“操作3”中缓慢加入过量18%的盐酸,充分搅拌直至(填现象变化),再冷却结晶。(5)、为检验所获得的产品中是否含有水杨酸,可选用的试剂为。(6)、为提高产品的产率,下列装置可能会用到的有。 (7)、用分光光度法测定阿司匹林粗产品的纯度。现测得阿司匹林标准溶液的吸光度A与其浓度关系如下图所示。
(7)、用分光光度法测定阿司匹林粗产品的纯度。现测得阿司匹林标准溶液的吸光度A与其浓度关系如下图所示。
准确称取16.0mg实验产品,用乙醇溶解并定容至100mL,测得溶液吸光度 , 则该产品的纯度是(以质量分数表示)。
18. 文拉法辛(化合物G)是一种用于治疗各类抑郁症的药物,其合成路线如下图所示:
回答下列问题:
(1)、A的化学名称是。(2)、C→D的反应类型是。(3)、E中手性碳原子有个。(4)、F中官能团的名称为。(5)、C发生消去反应生成的烯烃被足量酸性溶液氧化后的产物是和(写结构简式)。(6)、B的同分异构体中,同时满足下列条件的共有种。a.能发生银镜反应
b.遇溶液显紫色
(7)、以丙酮、、甲醛和甲酸为含碳原料,合成化合物 。基于你设计的合成路线,相关步骤涉及到氢气参与反应,其化学方程式为。 19. 丙烯是有机化工中的重要原料,可用丙烷直接脱氢工艺和丙烷氧化脱氢工艺制备,其主反应和有关物质的燃烧热数据如下。
。基于你设计的合成路线,相关步骤涉及到氢气参与反应,其化学方程式为。 19. 丙烯是有机化工中的重要原料,可用丙烷直接脱氢工艺和丙烷氧化脱氢工艺制备,其主反应和有关物质的燃烧热数据如下。Ⅰ.丙烷直接脱氢工艺:
Ⅱ.丙烷氧化脱氢工艺:
物质
燃烧热
-2219.9
-2058.0
-285.8
回答下列问题:
(1)、反应Ⅰ的 , 其自发进行的条件是。丙烷在不同温度下按照一定流速通过铬催化剂反应相同时间,所得混合物中部分物质的体积分数如下表所示,实际控制温度为580℃,原因是。510℃
550℃
580℃
620℃
丙烷(%)
64.82
57.87
37.76
31.91
丙烯(%)
12.33
1585
22.72
23.13
乙烯(%)
0.12
0.19
0.20
0.71
甲烷(%)
1.50
2.78
4.03
7.31
氢气(%)
20.47
18.99
25.45
31.14
(2)、①反应Ⅱ属于自由基反应,其反应历程如下,写出第iv步的反应方程式。i)
ii)
iii)
iv)。
(3)、将、置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ:。达平衡时的体积分数 , , 则的选择性为(的选择性 , 计算结果保留3位有效数字),反应Ⅲ的(用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。(4)、使用惰性电极电解的酸性溶液制丙烯,其装置如下图所示。
①若以铅酸蓄电池作为直流电源,其工作时负极质量(填“增大”“减小”或“不变”)。
②X电极的电极反应式为。